 Adénomes hypophysaires
Adénomes hypophysaires
1. Définition
Les adénomes hypophysaires sont des tumeurs développées à partir des cellules de l’antéhypophyse.
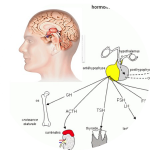
L’hypophyse (figure 1) est une glande d’environ 10 mm composée de 2 parties : l’antéhypophyse ou adénohypophyse qui sécrètent les hormones ACTH (Adrenocorticotrophin Hormon), GH (Growth Hormon), TSH (Thyroid Stimuling Hormon), FSH (Follicle Stimuling Hormon), LH (Lutropin Hormon), PRL (Prolactin) sous l’influence de l’hypothalamus, et la post hypophyse ou neurohypophyse qui sécrètent l’ocytocine (action utérine) et la vasopressine ou ADH (Anti Diuretic Hormon, action antidiurétique) qui contrôlent le volume de l’excrétion urinaire par rapport aux boissons.
Ces tumeurs sont le plus souvent bénignes et les cellules tumorales conservant une partie de leurs propriétés peuvent sécréter les hormones précitées.
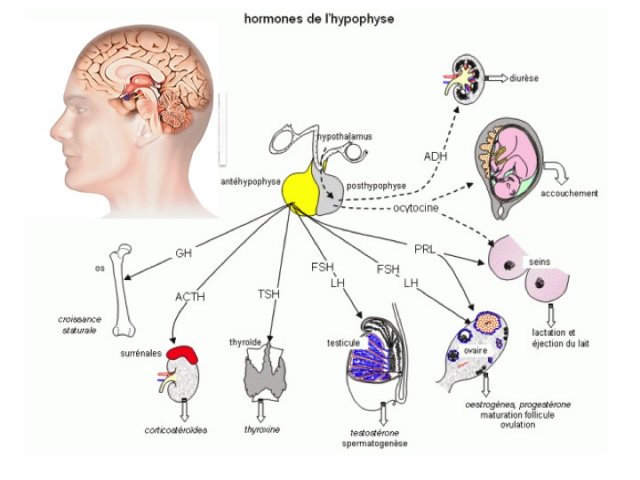
- L’hypophyse (figure 1)
2. Historique
L’anatomie de l’hypophyse est connue depuis l’antiquité gréco-romaine avec notamment les travaux d’Hippocrate et de Galien 29,43. Ce dernier en fait une voie d’ « évacuation des déchets de l’encéphale », notion qui sera enseignée pendant des millénaires aux étudiants en médecine. Un début de remise en cause des notions introduites par Galien débutera avec les travaux de Vespasien 73 pendant la Renaissance mais la relation entre maladies et tumeurs hypophysaires ne commencera réellement qu’avec la méthode anatomo-clinique au 17ième siècle. Jean Louis Petit (1674-1750) démontre ainsi que le développement d’une tumeur de l’hypophyse peut causer une cécité 43. Pierre Marie (1853-1940), en 1886, fait le lien entre les symptômes de l’acromégalie et une tumeur de l’hypophyse 46. L’hypopituitarisme est relié à un dysfonctionnement de l’hypophyse en 1901 par A Froelich (1871-1953) et H Cushing dans son ouvrage « The Pituitary Body and its Disorders » décrira finalement les différents tableaux cliniques d’hypo ou d’hypersécrétion connus de nos jours 21,43.
3. Epidémiologie et classifications des adénomes hypophysaires
Les adénomes hypophysaires représentent entre 10 et 20% des tumeurs intracrâniennes de l’adulte. Ces tumeurs ont une prévalence de 78 à 94/100 000 habitants et une incidence de 4/100 000 habitants avec une tendance à l’augmentation des découvertes fortuites, « incidentalomes » 37. Il s’agit d’une tumeur rare (2,7% des tumeurs supratentorielles) 39 chez l’enfant dont la tumeur de la région hypophysaire est le plus souvent un craniopharyngiome.
Depuis l’avènement de l’immunohistochimie, plusieurs sous-types histologiques correspondants aux différents tableaux cliniques sont individualisés.
Il est ainsi décrit des adénomes sécrétants ou fonctionnels : ![]() L’adénome à prolactine (PRL) est le plus fréquent (60% de l’ensemble des adénomes, ratio femme-homme : 10/1, une prévalence de 440/100000 et un âge moyen au diagnostic de 32 ans) 37.
L’adénome à prolactine (PRL) est le plus fréquent (60% de l’ensemble des adénomes, ratio femme-homme : 10/1, une prévalence de 440/100000 et un âge moyen au diagnostic de 32 ans) 37.![]() L’adénome somatotrope sécrétant l’hormone de croissance (GH) représente environ 13 % de l’ensemble des adénomes avec une prévalence estimée à 40 à 130/million ; l’âge au diagnostic est de 47 ans 37 avec une variante fréquente l’adénome somatoprolactinique, sécrétant de la PRL et de la GH (50% des adénomes somatotropes).
L’adénome somatotrope sécrétant l’hormone de croissance (GH) représente environ 13 % de l’ensemble des adénomes avec une prévalence estimée à 40 à 130/million ; l’âge au diagnostic est de 47 ans 37 avec une variante fréquente l’adénome somatoprolactinique, sécrétant de la PRL et de la GH (50% des adénomes somatotropes).![]() L’adénome corticotrope a une prévalence de 0,17/100000 37. Ces adénomes majoritairement de petite taille (<10mm) ou « micro-adénomes » sécrètent de l’ACTH et représentent 6% de l’ensemble des adénomes. Les macroadénomes sont moins fréquents.
L’adénome corticotrope a une prévalence de 0,17/100000 37. Ces adénomes majoritairement de petite taille (<10mm) ou « micro-adénomes » sécrètent de l’ACTH et représentent 6% de l’ensemble des adénomes. Les macroadénomes sont moins fréquents.![]() L’adénome thyréotrope secrétant la TSH est rare (<1% de l’ensemble des adénomes) avec une prévalence de 0,15/2,8 millions 53. Il s’accompagne le plus souvent d’une hyperthyroïdie, mais il peut être silencieux et plurisécrétant (TSH-GH et TSH-PRL).
L’adénome thyréotrope secrétant la TSH est rare (<1% de l’ensemble des adénomes) avec une prévalence de 0,15/2,8 millions 53. Il s’accompagne le plus souvent d’une hyperthyroïdie, mais il peut être silencieux et plurisécrétant (TSH-GH et TSH-PRL).
A côté de ces adénomes dit sécrétants sont décrits des adénomes non sécrétants ou non fonctionnels (30% des adénomes hypophysaires). Ce dernier terme « non fonctionnel » doit être préféré, car dans environ un tiers des cas 22,23,35, il existe une expression hormonale, sans traduction clinique, mais pouvant servir de marqueur biologique.![]() Ces tumeurs sont en majorité des adénomes gonadotropes, issus des cellules gonadotropes sécrétant FSH, LH ou la sous-unité α (ces hormones « gonadotrophines », glycoprotidiques étant composées de 2 sous-unités α et β).
Ces tumeurs sont en majorité des adénomes gonadotropes, issus des cellules gonadotropes sécrétant FSH, LH ou la sous-unité α (ces hormones « gonadotrophines », glycoprotidiques étant composées de 2 sous-unités α et β). ![]() Les adénomes silencieux sont moins fréquents et habituellement considérés comme agressifs. Il s’agit d’adénomes se révélant par un syndrome tumoral sans tableau clinique spécifique d’hypersécrétion, mais qui en immunocytochimie sont positifs pour l’ACTH, la GH, ou la TSH voire plurihormonaux (GH et PRL ou TSH et GH). Biologiquement, soit ils ne sécrètent pas d’hormone, soit plus fréquemment, ils sécrètent une pro-hormone inactive expliquant l’absence de signes cliniques ou une hormone en faible quantité, mais dosable (hypersécrétion d’ACTH sans hypercorticisme pour l’exemple le plus fréquent).
Les adénomes silencieux sont moins fréquents et habituellement considérés comme agressifs. Il s’agit d’adénomes se révélant par un syndrome tumoral sans tableau clinique spécifique d’hypersécrétion, mais qui en immunocytochimie sont positifs pour l’ACTH, la GH, ou la TSH voire plurihormonaux (GH et PRL ou TSH et GH). Biologiquement, soit ils ne sécrètent pas d’hormone, soit plus fréquemment, ils sécrètent une pro-hormone inactive expliquant l’absence de signes cliniques ou une hormone en faible quantité, mais dosable (hypersécrétion d’ACTH sans hypercorticisme pour l’exemple le plus fréquent).![]() Les adénomes immunonégatifs ne réagissant avec aucun anticorps sont actuellement très rares (<5%). Il s’agirait d’une forme indifférenciée d’adénomes gonadotropes.
Les adénomes immunonégatifs ne réagissant avec aucun anticorps sont actuellement très rares (<5%). Il s’agirait d’une forme indifférenciée d’adénomes gonadotropes.
Les adénomes hypophysaires sont considérés comme des tumeurs bénignes mais il existe de véritables adénomes agressifs ou atypiques et carcinomes. La fréquence des adénomes agressifs est encore méconnue, 15% de grade 2b dans l’étude de J Trouillas et al 75 ainsi que dans la série de Laws 80. Seules 0,2% des tumeurs présentant des métastases au cours de l’évolution sont considérées comme des carcinomes : sécrétants pour la plupart - 36% de PRL, 30% d’ACTH - et non sécrétants dans uniquement 23%. Ces métastases jamais inaugurales surviennent 5 à 16 ans après le début de l’histoire clinique et concernent soit le système nerveux avec une dissémination par le liquide cérébro-spinal (LCS) soit systémiques pulmonaires, osseuses, hépatiques voire dans les ganglions lymphatiques (dissémination hématogène) 26. La survie des patients est alors de 4 ans.
Selon la WHO (World Health Organization) classification de l’OMS [1], ces tumeurs sont classées en 3 types : les adénomes bénins, « atypiques » (exprimant fortement la p53, de nombreuses mitoses, sans valeur seuil pour ces 2 marqueurs et un KI-67>3%) et les carcinomes (avec des métastases cérébro-spinales ou systémiques). Cette classification n’a pas de valeur pronostique, car ne s’accompagnant pas de corrélations anatomo-cliniques.
La deuxième classification plus récente est issue d’un travail français, multidisciplinaire et multicentrique dans le cadre d’une étude cas témoin rétrospective portant sur 410 patients opérés 75. Dans cette étude, l’invasion a été définie par un envahissement radiologique (IRM) et/ou histologique du sinus sphénoïdal - avec franchissement de la dure-mère et de l’os et surtout du sinus caverneux 20,38. La prolifération a été définie à l’histologie par la présence de 2 des trois marqueurs suivants : des mitoses (n>2/10 champs au 40), un index de KI-67 > 3% et une p53 positive (>10 noyaux/10 champs au 40). En fonction de l’invasion et de la prolifération, 5 grades ont été définis (figure 2) : grade 1a non invasif non proliférant, grade 1b non invasif mais proliférant, grade 2a invasif non proliférant, grade 2b invasif et proliférant, grade 3 métastatique. Cette classification s’est avérée capable de prédire la guérison et la récidive/progression à 8 ans quelque soit le sous type histologique. Elle individualise des tumeurs de grade 2b, à fort risque de résidu tumoral (25 fois supérieur au grade 1a) ou de récidive/progression (12 fois supérieur au grade 1a). L’objectif de ces classifications est de permettre au clinicien de s’appuyer sur des données objectives pour prendre des décisions de traitement complémentaire en cas de résidu post-chirurgical.

- Figure 2 : la classification des adénomes hypophysaires. Cinq grades ont été individualisés dans cette étude rétrospective multicentrique. Le grade 2b a été corrélé à des taux de récidive importants justifiant une vigilance accrue et une prise en charge plus agressive. Cela doit néanmoins être confirmé par des études prospectives.
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica

