 Douleur chronique.
Douleur chronique.
VII.3. Indications et conduites à tenir
Après avoir présenté les différents types de douleurs et les modalités de traitement à la disposition du médecin algologue et du neurochirurgien, nous nous proposons ici de détailler les indications des méthodes chirurgicales en fonction des types de douleurs et de leur cause.
VII.3.1.Douleurs d’origine cancéreuse
En cas de douleurs dans un contexte d’affection cancéreuse, la neurochirurgie ne s’envisagera qu’après un traitement bien conduit de la pathologie néoplasique et de ses conséquences, et seulement en cas d’échappement des douleurs au traitement médical antalgique. Cependant, sa place devrait être considérée avant d’utiliser des doses massives de médicaments avec leurs effets toxiques.
Elle ne peut cependant être indiquée qu’à certaines conditions :
- Des douleurs suffisamment focalisées pour que la chirurgie puisse couvrir l’ensemble du territoire douloureux, et des lésions causales suffisamment circonscrites pour qu’il n’y ait pas d’échappement précoce de l’effet antalgique.
- Une espérance de survie suffisamment longue, surtout s’il s’agit d’une chirurgie invasive.
- Un état général, notamment immunitaire, permettant d’envisager une chirurgie sans risque excessif d’infection ou de complications générales, sauf bien entendu si l’altération de l’état général est liée à la consommation importante de médicaments antalgiques et anti-inflammatoires.
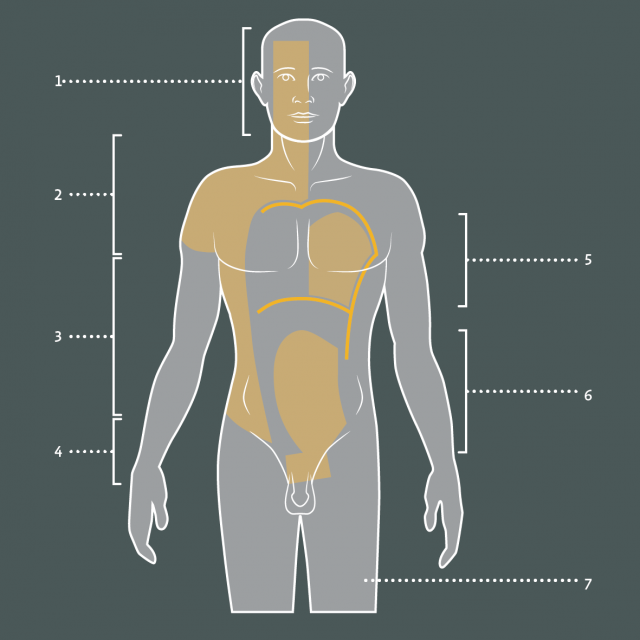
- Figure 18
Figure 19 : Interventions envisageables dans les douleurs d’origine cancéreuse. Le type et le niveau des interventions dépendent du siège et de l’étendue des lésions responsables des douleurs. 1. Interruption des nerfs crâniens sensitifs ou Tractotomie spinothalamique mésencéphalique ; 2. DREZotomie cervicale ; 3. Radicotomie dorsale ou DREZotomie des racines thoraciques ; 4. DREZotomie sacrée ou pharmacothérapie intrathécale ; 5. Cordotomie controlatérale cervicale haute ou tractotomie spinothalamique mésencéphalique ; 6. Pharmacothérapie intrathécale ou cordotomie bilatérale cervicale basse ou myélotomie commissurale si douleurs bilatérales ; 7. Cordotomie cervicale basse controlatérale.
Territoire cervico-facial
En cas de douleurs limitées au territoire trigéminal, il peut être envisagé une section juxtaprotubérantielle de la pars major de la racine trigéminaleau niveau de l’angle ponto-cérébelleux (APC). Si l’état de la joue et de la fosse ptérygo-maxillaire le permet, il peut également être réalisé une thermocoagulation percutanée par voie transovale de Hartel.
Si la douleur est étendue aux territoires des nerfs glossopharyngien et/ou vague, l’on peut y associer leur section dans l’APC ou effectuer une thermocoagulation percutanée au niveau du ganglion d’Andersch au foramen jugularis.
Si la douleur est étendue aux territoires des racines cervicales supérieures, leur interruption pluriétagée peut être faite par abord direct ou par thermocoagulation percutanée dans leurs foramens de conjugaison.
En cas de douleur étendue, il peut être pratiqué une interruption du tractus spinal descendant au niveau bulbaire et/ou une lésion du noyau spinal descendant par voie microchirurgicale (intervention de SJOQVIST(110)et KUNC(49)), ou par voie percutanée scan-guidée(45). Enfin la morphinothérapie intraventriculaire peut également être envisagée.
Territoire du plexus brachial
En cas de douleurs liées à un syndrome de l’apex thoracique (le plus souvent de topographie C7-T2), la DREZotomie est la technique la mieux indiquée.
Si la douleur est plus étendue, l’on peut envisager une cordotomie controlatérale en C2. Il est important de prendre alors en compte le risque d’aggraver les troubles respiratoires notamment s’il existe une réduction pulmonaire ou une paralysie phrénique par envahissement tumoral.
Il peut également être envisagée une tractotomie mésencéphalique stéréotaxique controlatérale, moins risquée sur le plan ventilatoire.
La morphinothérapie intraventriculaire reste une option malgré le risque infectieux important lié à l’implantation de matériel étranger.
Territoire pariétal thoracique
Lorsqu’elles sont limitées, ces douleurs peuvent bénéficier de blocs et neurolyses paravertébraux, de thermorhizotomies percutanées ou encore d’une radicotomie postérieure ou d’une DREZotomie aux niveaux correspondants.
Territoire périnéopelvien
Ces douleurs relèvent principalement de la morphinothérapie intrathécale. Celle-ci peut consister en des injections répétées dans un site d’accès (réservoir sous-cutané relié à un cathéter intrathécal) en cas d’espérance de vie limitée. Elle peut également être dispensée par une pompe programmable implantée si l’espérance de vie est suffisament prolongée.
On peut également recourir à la cordotomie bilatérale cervicale basse (pour éviter une atteinte phrénique bilatérale) ou à la myélotomie commissurale par abord direct ou centro-médullaire percutané s’il existe déjà une abolition des fonctions génito-sphinctériennes. En cas de survie brève, peut être envisagé une phénolysation intrathécale.
Enfin lorsque les douleurs sont limitées au plancher pelvien avec perte des fonctions correspondantes, le recours peut être une DREZotomie des seuls segments sacrés.
Territoires du plexus lombosacréou d’un seul membre inférieur
La cordotomie unilatérale controlatérale est la technique privilégiée seulement si le membre est très déficitaire, il peut également être envisagé une DREZotomie lombosacrée étendue.
Territoire solaire
Ces douleurs relèvent principalement de l’infiltration de substances neurolytiques au niveau du plexus coeliaque et des nerfs splanchniques ou d’une implantation thoracique haute (T6) d’un cathéter intrathécal pour injection de morphine et anesthésiques locaux.
Territoire radiculaire (infiltration par tumeur vertébrale et/ou épidurale)
La chirurgie antalgique peut être associée à une chirurgie de décompression suivie éventuellement d’une ostéosynthèse de la tumeur. Il peut y être associé une radicotomie postérieure extradurale ou une DREZotomie complémentaire si nécessaire.
Territoires osseux multiples
Lorsque les douleurs correspondent à une (ou un petit nombre) de vertèbres, le recours à une cimentoplastie/vertébroplastie est la solution. S’il s’agit d’un cancer hormonodépendant et que les lésions responsables sont disséminées, il peut être possible de recourir à une hypophysiolyse et/ou une hypophysectomie.
Douleurs associées
Il est fréquent de rencontrer des douleurs de mécanismes associés à l’excès de nociception qu’il s’agisse de douleurs régionales complexes et/ou de douleurs neuropathiques. Ces composantes relèvent des méthodes correspondantes.
VII.3.2.Douleurs neuropathiques
Comme expliqué précédemment, les douleurs neuropathiques sont consécutives à une lésion du système nerveux sensoriel somesthésique, et sont liées à la perte de différents mécanismes de contrôle de la perception douloureuse. Ces douleurs évoluent souvent au long cours. Lorsque ces douleurs deviennent résistantes aux traitements médicamenteux, elles peuvent relever de la chirurgie, le plus souvent de techniques de neuromodulation, conservatrices par nature, et parfois, dans des indications très précises, de techniques lésionnelles sélectives.
Douleurs des amputés
Ces douleurs peuvent être de plusieurs types :
Les névromes hypertrophiques sont décelés à la palpation comme une masse dont la mobilisation et la percussion entraînent des irradiations importantes. S’ils sont superficiels, ils peuvent être réséqués puis le nerf enfoui le plus profondément possible afin d’être à l’abri des stimulations extéroceptives.
Les douleurs du moignon surviennent par crises de déclenchement spontané. Elles relèvent de la stimulation transcutanée et éventuellement de la stimulation médullaire.
L’allodynie mécanique de contact peut bénéficier d’une DREZotomie pour diminuer le caractère provoqué par l’effleurement, si la stimulation médullaire n’a pas été effcicace.
Un membre fantôme douloureux pour lequel les stimulations transcutanée et médullaire se seraient révélées inefficaces peut relever d’une stimulation du cortex moteur en regard de la représentation du membre fantôme telle que localisée par l’IRM fonctionnelle. Si ces douleurs peuvent être mises en relation avec une avulsion plexique, la DREZotomie est la méthode de choix.
Douleurs liées à deslésions de nerfs périphériques
Si ces douleurs ont résisté aux libérations et réparations chirurgicales, elles relèvent d’abord de la stimulation transcutanée en regard des troncs correspondants, et si besoin de la stimulation médullaire. Si ces techniques sont inefficaces, une DREZotomie peut être envisagée à la condition que les composantes majoritaires de ces douleurs soient allodyniques et/ou paroxystiques.
Douleurs liées à des lésions d’avulsion plexique
Il est important de différencier les lésions situées centralement et périphériquement par rapport au ganglion spinal.
En effet les lésions situées en distalité (rares) peuvent relever de la stimulation médullaire tandis que les lésions situées entre le ganglion et la moëlle sont a priori résistantes à la stimulation médullaire du fait de la dégénérescence des fibres cordonales postérieures jusqu’au tronc cérébral. L’étude du temps de conduction central (TCC) des PES peut aider au diagnostic d’intégrité de ces fibres. Si la stimulation médullaire est contre-indiquée faute de fibres fonctionnelles, le recours à la stimulation thalamique du noyau somesthésique VPL ou à la stimulation corticale peut être envisagé mais leur efficacité reste modérée.
La méthode la plus logique pour ces douleurs est la DREZotomie. Elle obtient une sédation presque toujours complète et dans presque tous les cas des composantes paroxystiques et allodyniques. L’effet sur les composantes permanentes, et à type de brûlure en particulier, n’est obtenu que dans 56% des cas(2).
Douleurs liées à des lésions radiculairespost-chirurgicales rachidiennes
Les douleurs radiculaires post-chirurgicales ne peuvent répondre à la stimulation transcutanée et/ou médullaire qu’à la condition qu’il n’existe pas de dégénérescence importante des fibres sensitives à destinée cordonale postérieure correspondantes. Il convient donc de s’assurer de leur normalité par la mesure du TCC sur les potentiels évoqués somesthésiques, et si nécessaire d’effectuer un test d’efficacité percutané.
Douleurs post-zostériennes
Il s’agit de douleurs complexes et difficiles à contrôler du fait de l’atteinte généralement sévère du ganglion spinal et de la corne postérieure de la moëlle. Si les fibres ascendantes des colonnes dorsales sont préservées, une stimulation médullaire peut être envisagée. Dans le cas contraire, et si la composante allodynique et/ou paroxystique est importante, une DREZotomie peut être indiquée. A l’intervention, il est généralement constaté que les racines correspondantes sont atrophiques et de coloration grise liée à leur démyélinisation, ce qui permet de bien localiser la chirurgie à leur niveau.
Douleursliées aux lésions médullaires
Ces douleurs ne peuvent répondre à la stimulation médullaire qu’à la condition que les voies sensitives des colonnes dorsales soient préservées. Ceci peut être vérifié par l’étude des PES par la stimulation des nerfs tibiaux et fémoraux pour les membres inférieurs et du médian et de l’ulnaire pour les membres supérieurs.
Les douleurs de niveau segmentaires peuvent bénéficier d’une DREZotomie, en particulier si ces douleurs sont à prédominance paroxystique(108).
Douleurs liées à des lésions thalamiques
Les douleurs centrales, en particulier celles survenant au décours d’accidents vasculaires cérébraux, telles que rencontrées dans les syndromes dits thalamiques (syndrome de Dejerine-Roussy notamment) ou dans les syndromes de Wallenberg sont pour la plupart rebelles aux traitement médicaux.
Un recours chirurgical logique est la stimulation du cortex moteur. Elle permet une obtention de 50% de soulagement chez plus de 60% des patients(73,80,82).
Douleurs de l’extrémité céphalique
- Les douleurs neuropathiques en territoire trigéminal (à différencier des névralgies trigéminales) peuvent résulter de lésions odontologiques, stomatologiques ou maxillo-faciales, post-traumatiques voire post-chirurgicales. Elles peuvent relever de la stimulation du ganglion de Gasser par voie percutanée ou par voie ouverte sous-temporale ; mais celle-ci ne peut être efficace que si les fibres rétro-gassériennes conservent leur intégrité fonctionnelle. Une chirurgie lésionnelle, par exemple la thermocoagulation percutanée, ne serait admissible que si la douleur était majoritairement allodynique et/ou paroxystique. Les douleurs à type d’anesthésie douloureuse et/ou de dysesthésies comme parfois rencontrées après chirurgie lésionnelle pour névralgie trigéminale, peuvent faire discuter une stimulation thalamique du noyau VPL ou une stimulation corticale.
- La névralgie du nerf occipital rebelle aux traitements médicamenteux et aux infiltrations peut relever de la chirurgie de stimulation sous-cutanée du nerf grand occipital. (Cf. Paragraphe dédié à la stimulation des nerfs périphériques).
VIII.Conclusion
La neurochirurgie de la douleur s’adresse aux douleurs ayant résisté à leur traitement étiologique complètement conduit et devenues chroniques, lorsqu’elles sont intolérables et réfractaires aux traitements médicaux. Les indications doivent être posées après une analyse précise de la symptomatologie et une évaluation pluridisciplinaire de la pathologie. Le résultat dépend étroitement de l’adéquation entre physiopathologie des douleurs et type de chirurgie envisagé.
Bibliographie
1.Adams JE, Hosobuchi Y, Fields HL.Stimulation of internal capsule for relief of chronic pain. J Neurosurg. 1974 ;41:740–4. C4
2.Aichaoui F, Mertens P, Sindou M. Dorsal root entry zone lesioning for pain after brachial plexus avulsion : results with special emphasis on differential effects on the paroxysmal versus the continuous components. A prospective study in a 29-patient consecutive series. Pain. 2011 ;152:1923–30.C4
3.André-Obadia N, Peyron R, Mertens P, Mauguière F, Laurent B, Garcia-Larrea L. Transcranial magnetic stimulation for pain control. Double-blind study of different frequencies against placebo, and correlation with motor cortex stimulation efficacy. Clin Neurophysiol Off J Int Fed Clin Neurophysiol. 2006 ;117:1536–44.B2
4.Antonaci F, Sjaastad O. Cervicogenic headache : a real headache. Curr Neurol Neurosci Rep. 2011 ;11:149–55.C4
5.Bansal D, Bhansali A, Hota D, Chakrabarti A, Dutta P. Amitriptyline vs. pregabalin in painful diabetic neuropathy : a randomized double blind clinical trial. Diabet Med J Br Diabet Assoc. 2009 ;26:1019–26.A1
6.Le Bars D, Dickenson AH, Besson JM. Diffuse noxious inhibitory controls (DNIC). I. Effects on dorsal horn convergent neurones in the rat. Pain. 1979 ;6:283–304.C4
7.Le Bars D, Dickenson AH, Besson JM. Diffuse noxious inhibitory controls (DNIC). II. Lack of effect on non-convergent neurones, supraspinal involvement and theoretical implications. Pain. 1979 ;6:305–27.C4
8.Besson J, Dickenson A, Le Bars D, Oliveras J. Opiate analgesia : The physiology and pharmacology of spinal pain systems.Adv Pharmacol Ther. 1978 ;5:61–81.C4
9.Bioy A, Wood C, Françoise B. Thérapies à médiation corporelle et douleur. Ruel-Malmaison : Institut UPSA de la douleur ; 2013.C4
10.Blond S, Assaker R, Meynadier J, Merienne L. [Stereotaxic mesencephalic tractotomy : its value in the treatment of neoplastic cervicofacial pain].Agressol Rev Int Physio-Biol Pharmacol Appl Aux Eff Agression. 1988 ;29:77–80.C4
11.Bouhassira D, Attal N, Alchaar H, Boureau F, Brochet B, Bruxelle J, et al.Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4).Pain. 2005 ;114:29–36.C3
12.Bouhassira D, Attal N, Fermanian J, Alchaar H, Gautron M, Masquelier E, et al.Development and validation of the Neuropathic Pain Symptom Inventory. Pain. 2004 ;108:248–57.C4
13.Bouhassira D, Lantéri-Minet M, Attal N, Laurent B, Touboul C. Prevalence of chronic pain with neuropathic characteristics in the general population : Pain. 2008 ;136:380–7.C4
14.Boureau F, Luu M, Doubrère JF. Comparative study of the validity of four French McGill Pain Questionnaire (MPQ) versions. Pain. 1992 ;50:59–65.C3
15.Breivik H, Collett B, Ventafridda V, Cohen R, Gallacher D. Survey of chronic pain in Europe : prevalence, impact on daily life, and treatment. Eur J Pain Lond Engl. 2006 ;10:287–333.C4
16.Burchiel KJ. [(Surgical Management of Pain)]. Thieme Medical Publishers Inc ; 2015.C4
17.Chen Y-F, Bramley G, Unwin G, Hanu-Cernat D, Dretzke J, Moore D, et al. Occipital Nerve Stimulation for Chronic Migraine—A Systematic Review and Meta-Analysis. Sommer C, editor. PLOS ONE. 2015 ;10:e0116786.A1
18.Crue BL, Todd EM. A SIMPLIFIED TECHNIQUE OF SACRAL RHIZOTOMY FOR PELVIC PAIN. J Neurosurg. 1964 ;21:835–7.C4
19.Decq P, Mertens P. [Indications of neurosurgical procedures for spasticity].Neurochirurgie. 2003 ;49:404–7.C4
20.Deer TR, Mekhail N, Provenzano D, Pope J, Krames E, Leong M, et al.The Appropriate Use of Neurostimulation of the Spinal Cord and Peripheral Nervous System for the Treatment of Chronic Pain and Ischemic Diseases : The Neuromodulation Appropriateness Consensus Committee : Appropriate Use of Neurostimulation. Neuromodulation Technol Neural Interface. 2014 ;17:515–50.C4
21.Fairman D. Neurophysiological basis for the hypothalamic lesion and stimulation by chronic implanted electrodes for the relief of intractable pain in cancer. Adv Pain Res Ther. 1976 ;843–7.C4
22.Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH, et al. Pharmacotherapy for neuropathic pain in adults : a systematic review and meta-analysis. Lancet Neurol. 2015 ;14:162–73.A1
23.Fontaine D, Vandersteen C, Magis D, Lanteri-Minet M. Neuromodulation in cluster headache. Adv Tech Stand Neurosurg. 2015 ;42:3–21.C4
24.Franzini A, Ferroli P, Leone M, Broggi G. Stimulation of the posterior hypothalamus for treatment of chronic intractable cluster headaches : first reported series. Neurosurgery. 2003 ;52:1095–9 ; discussion 1099–101.C4
25.Freedman M, Greis AC, Marino L, Sinha AN, Henstenburg J. Complex Regional Pain Syndrome.Phys Med Rehabil Clin N Am. 2014 ;25:291–303.C4
26.García-Larrea L, Peyron R, Mertens P, Gregoire MC, Lavenne F, Le Bars D, et al.Electrical stimulation of motor cortex for pain control : a combined PET-scan and electrophysiological study.Pain. 1999 ;83:259–73.C4
27.García-Larrea L, Peyron R, Mertens P, Grégoire MC, Lavenne F, Bonnefoi F, et al.Positron emission tomography during motor cortex stimulation for pain control. Stereotact Funct Neurosurg. 1997 ;68:141–8.C4
28.García-Larrea L, Sindou M, Mauguière F. Nociceptive flexion reflexes during analgesic neurostimulation in man. Pain. 1989 ;39:145–56.C4
29.Geurts JW, Smits H, Kemler MA, Brunner F, Kessels AGH, van Kleef M. Spinal cord stimulation for complex regional pain syndrome type I : a prospective cohort study with long-term follow-up. Neuromodulation J Int Neuromodulation Soc. 2013 ;16:523–9 ; discussion 529.C4
30.Gibbons RJ, Abrams J, Chatterjee K, Daley J, Deedwania PC, Douglas JS, et al. ACC/AHA 2002 guideline update for the management of patients with chronic stable angina—summary article : a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (Committee on the Management of Patients With Chronic Stable Angina).J Am Coll Cardiol. 2003 ;41:159–68.C4
31.Gueguen J, Barry C, Hassler C, Falissard B. Evaluation de l’efficacité de la pratique de l’hypnose.2015 ;C4
32.Guenot M, Bullier J, Sindou M. Clinical and electrophysiological expression of deafferentation pain alleviated by dorsal root entry zone lesions in rats. J Neurosurg. 2002 ;97:1402–9.C4
33.Guenot M, Hupe JM, Mertens P, Ainsworth A, Bullier J, Sindou M. A new type of microelectrode for obtaining unitary recordings in the human spinal cord.J Neurosurg. 1999 ;91:25–32.C4
34.Hayek SM, Deer TR, Pope JE, Panchal SJ, Patel VB.Intrathecal therapy for cancer and non-cancer pain. Pain Physician. 2011 ;14:219–48.B2
35.Headache Classification Committee of the International Headache Society (IHS). The International Classification of Headache Disorders, 3rd edition (beta version). Cephalalgia Int J Headache. 2013 ;33:629–808.C4
36.Head H, Holmes G. Sensory disturbances from cerebral lesions. Brain. 1911 ;102–254.C4
37.Hitchcock E. Stereotactic cervical myelotomy. J Neurol Neurosurg Psychiatry. 1970 ;33:224–30.C4
38.Hollingshead J, Dühmke RM, Cornblath DR. Tramadol for neuropathic pain. Cochrane Database Syst Rev. 2006 ;CD003726.A1
39.Hosobuchi Y, Adams JE, Linchitz R. Pain relief by electrical stimulation of the central gray matter in humans and its reversal by naloxone. Science. 1977 ;197:183–6.C4
40.Hosobuchi Y, Adams JE, Rutkin B. Chronic thalamic stimulation for the control of facial anesthesia dolorosa. Arch Neurol. 1973 ;29:158–61.C4
41.Hosobuchi Y, Adams JE, Rutkin B. Chronic thalamic and internal capsule stimulation for the control of central pain. Surg Neurol. 1975 ;4:91–2.C4
42.Jeanmonod D, Sindou M. Somatosensory function following dorsal root entry zone lesions in patients with neurogenic pain or spasticity. J Neurosurg. 1991 ;74:916–32.C4
43.Jeanmonod D, Sindou M, Magnin M, Boudet M. Intra-operative unit recordings in the human dorsal horn with a simplified floating microelectrode. Electroencephalogr Clin Neurophysiol. 1989 ;72:450–4.C4
44.Jeanmonod D, Sindou M, Mauguière F. The human cervical and lumbo-sacral evoked electrospinogram. Data from intra-operative spinal cord surface recordings. Electroencephalogr Clin Neurophysiol. 1991 ;80:477–89.C4
45.Kanpolat Y, Kahilogullari G, Ugur HC, Elhan AH. Computed tomography-guided percutaneous trigeminal tractotomy-nucleotomy. Neurosurgery. 2008 ;63:ONS147–53 ; discussion ONS153–5.C4
46.Kapural L. Spinal Cord Stimulation for Intractable Chronic Pain. Curr Pain Headache Rep. 2014 ;18.C4
47.Katayama Y, Tsubokawa T, Yamamoto T. Chronic motor cortex stimulation for central deafferentation pain : experience with bulbar pain secondary to Wallenberg syndrome. Stereotact Funct Neurosurg. 1994 ;62:295–9.C4
48.Kéravel Y, Sindou M. Anatomical conditions of efficiency of transcutaneous electrical neurostimulation in deafferentation pain. Adv Pain Res Ther. 1984 ;763–7.C4
49.Kunc Z. Treatment of essential neuralgia of the 9th nerve by selective tractotomy. J Neurosurg. 1965 ;23:494–500.C4
50.Lazorthes Y, Verdie JC. [Treatment using percutaneous thermocoagulation of trigeminal and glossopharyngeal neuralgias]. Bull Groupèment Int Pour Rech Sci En Stomatol Odontol. 1977 ;20:297–309.C4
51.Lazorthes Y, Verdie JC, Bastide R, Lavados A, Descouens D. Spinal versus intraventricular chronic opiate administration with implantable drug delivery devices for cancer pain. Appl Neurophysiol. 1985 ;48:234–41.C4
52.Lee AW, Pilitsis JG. Spinal cord stimulation : indications and outcomes.Neurosurg Focus. 2006 ;21:E3.C4
53.Lefaucheur J-P, André-Obadia N, Antal A, Ayache SS, Baeken C, Benninger DH, et al.Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS).Clin Neurophysiol. 2014 ;125:2150–206.A1
54.Leriche R. La chirurgie de la douleur.Masson. Paris ; 1940.C4
55.Levy RM, Lamb S, Adams JE. Treatment of chronic pain by deep brain stimulation : long term follow-up and review of the literature. Neurosurgery. 1987 ;21:885–93.C4
56.Linderoth B, Stiller CO, Gunasekera L, O’Connor WT, Ungerstedt U, Brodin E. Gamma-aminobutyric acid is released in the dorsal horn by electrical spinal cord stimulation : an in vivo microdialysis study in the rat. Neurosurgery. 1994 ;34:484–8 ; discussion 488–9.C4
57.Loeser JD, Ward AA. Some effects of deafferentation on neurons of the cat spinal cord. Arch Neurol. 1967 ;17:629–36.C4
58.Loeser JD, Ward AA, White LE. Chronic deafferentation of human spinal cord neurons. J Neurosurg. 1968 ;29:48–50.C4
59.Loeser JD, Treede R-D. The Kyoto protocol of IASP Basic Pain Terminology. Pain. 2008 ;137:473–7.C4
60.Long DM. Stimulation of the peripheral nervous system for pain control. Clin Neurosurg. 1983 ;31:323–43.C4
61.Maarrawi J, Mertens P, Peyron R, Garcia-Larrea L, Sindou M. Functional exploration for neuropathic pain. Adv Tech Stand Neurosurg.2011 ;25–63.C4
62.Maarrawi J, Peyron R, Mertens P, Costes N, Magnin M, Sindou M, et al.Brain opioid receptor density predicts motor cortex stimulation efficacy for chronic pain. Pain. 2013 ;154:2563–8.C4
63.Maarrawi J, Peyron R, Mertens P, Costes N, Magnin M, Sindou M, et al. Motor cortex stimulation for pain control induces changes in the endogenous opioid system. Neurology. 2007 ;69:827–34.C4
64.Macfarlane GJ. The epidemiology of chronic pain : PAIN. 2016 ;157:2158–9.C4
65.Maher RM. Neurone selection in relief of pain : further experiences with intrathecal injections. Lancet Lond Engl. 1957 ;272:16–9.C4
66.Mansuy L, Sindou M, Fischer G, Brunon J. [Spino-thalamic cordotomy in cancerous pain. Results of a series of 124 patients operated on by the direct posterior approach]. Neurochirurgie. 1976 ;22:437–44.C4
67.Martinez V, Attal N, Bouhassira D, Lantéri-Minet M. Chronic neuropathic pain : Diagnosis, evaluation and treatment in outpatient services. Guidelines for clinical practice of the French Society for the Study and Treatment of Pain.Douleurs Eval - Diagn - Trait. 2010 ;11:3–21.C4
68.Mazars G. La Chirurgie de la Douleur.Masson. Paris ; 1976.C4
69.Mazars GJ. Intermittent stimulation of nucleus ventralis posterolateralis for intractable pain. Surg Neurol. 1975 ;4:93–5.C4
70.Melzack R, Wall PD. Pain mechanisms : a new theory. Science. 1965 ;150:971–9.C4
71.Mertens P, Bierme T, Sindou M. [Functional neurosurgery of chronic pain : nociceptive tracts ablation at the level of the peripheral nervous system and spinal cord]. Agressol Rev Int Physio-Biol Pharmacol Appl Aux Eff Agression. 1993 ;34 Spec No 2:78–81.C4
72.Mertens P, Ghaemmaghami C, Bert L, Perret-Liaudet A, Guenot M, Naous H, et al. Microdialysis study of amino acid neurotransmitters in the spinal dorsal horn of patients undergoing microsurgical dorsal root entry zone lesioning.Technical note. J Neurosurg. 2001 ;94:165–73.C4
73.Mertens P, Nuti C, Sindou M, Guenot M, Peyron R, Garcia-Larrea L, et al.Precentral cortex stimulation for the treatment of central neuropathic pain : results of a prospective study in a 20-patient series. Stereotact Funct Neurosurg. 1999 ;73:122–5.C4
74.Meyerson B. Electrostimulation procedures : effects, presumed rationale and possible mechanisms. Adv Pain Res Ther. 1983 ;495–534.C4
75.Meyerson BA, Lindblom U, Linderoth B, Lind G, Herregodts P. Motor cortex stimulation as treatment of trigeminal neuropathic pain. Acta Neurochir Suppl (Wien). 1993 ;58:150–3.C4
76.Mironer YE, Hutcheson JK, Satterthwaite JR, LaTourette PC. Prospective, two-part study of the interaction between spinal cord stimulation and peripheral nerve field stimulation in patients with low back pain : development of a new spinal-peripheral neurostimulation method. Neuromodulation J Int Neuromodulation Soc. 2011 ;14:151–4 ; discussion 155.C4
77.Moniz E. I succeeded in performing the prefrontal leukotomy. J Clin Exp Psychopathol. 1954 ;15:373–9.C4
78.Navarro RM, Vercimak DC. Triangular stimulation method utilizing combination spinal cord stimulation with peripheral subcutaneous field stimulation for chronic pain patients : a retrospective study. Neuromodulation J Int Neuromodulation Soc. 2012 ;15:124–31.C4
79.Newsome S, Frawley BK, Argoff CE. Intrathecal analgesia for refractory cancer pain.Curr Pain Headache Rep. 2008 ;12:249–56.C4
80.Nguyen J-P, Lefaucheur J-P, Decq P, Uchiyama T, Carpentier A, Fontaine D, et al.Chronic motor cortex stimulation in the treatment of central and neuropathic pain. Correlations between clinical, electrophysiological and anatomical data. Pain. 1999 ;82:245–51.C4
81.North R, Shipley J, Prager J, Barolat G, Barulich M, Bedder M, et al. Practice parameters for the use of spinal cord stimulation in the treatment of chronic neuropathic pain. Pain Med Malden Mass. 2007 ;8 Suppl 4:S200–75.C4
82.Nuti C, Peyron R, Garcia-Larrea L, Brunon J, Laurent B, Sindou M, et al. Motor cortex stimulation for refractory neuropathic pain : Four year outcome and predictors of efficacy. Pain. 2005 ;118:43–52.C4
83.O’Connell NE, Wand BM, Marston L, Spencer S, DeSouza LH. Non-invasive brain stimulation techniques for chronic pain. In : The Cochrane Collaboration, editor. Cochrane Database of Systematic Reviews. Chichester, UK : John Wiley & Sons, Ltd ; 2014.C4
84.Perez RS, Zollinger PE, Dijkstra PU, Thomassen-Hilgersom IL, Zuurmond WW, Rosenbrand KC, et al.Evidence based guidelines for complex regional pain syndrome type 1. BMC Neurol.2010 ;10:20.A1
85.Peyron R, Garcia-Larrea L, Deiber MP, Cinotti L, Convers P, Sindou M, et al.Electrical stimulation of precentral cortical area in the treatment of central pain : electrophysiological and PET study. Pain. 1995 ;62:275–86.C4
86.Pluijms WA, Slangen R, Joosten EA, Kessels AG, Merkies ISJ, Schaper NC, et al. Electrical spinal cord stimulation in painful diabetic polyneuropathy, a systematic review on treatment efficacy and safety. Eur J Pain Lond Engl. 2011 ;15:783–8.C4
87.Polo G, Mertens P, Sindou M. Spinal cord stimulation for intractable pain. In : Deep Brain Stimulation for neurological disorders. Springer. Itakura T. ; 2015.C4
88.Pommier B, Créac’h C, Beauvieux V, Nuti C, Vassal F, Peyron R. Robot-guided neuronavigated rTMS as an alternative therapy for central (neuropathic) pain : Clinical experience and long-term follow-up. Eur J Pain Lond Engl. 2016 ;20:907–16.C4
89.Pope JE, Deer TR, Bruel BM, Falowski S. Clinical Uses of Intrathecal Therapy and Its Placement in the Pain Care Algorithm. Pain Pract Off J World Inst Pain. 2016 ;C4
90.Portenoy RK, Farrar JT, Backonja M-M, Cleeland CS, Yang K, Friedman M, et al. Long-term use of controlled-release oxycodone for noncancer pain : results of a 3-year registry study. Clin J Pain. 2007 ;23:287–99.C4
91.Quinones-Hinojosa A. Schmidek and Sweet : Operative Neurosurgical Techniques : Indications, Methods and Results (Expert Consult - Online and Print). Elsevier Health Sciences ; 2012. 3023 p.C4
92.Richardson DE, Akil H. Pain reduction by electrical brain stimulation in man. Part 1 : Acute administration in periaqueductal and periventricular sites. J Neurosurg. 1977 ;47:178–83.C4
93.Richardson DE, Akil H. Long term results of periventricular gray self-stimulation. Neurosurgery. 1977 ;1:199–202.C4
94.Rosomoff HL, Brown CJ, Sheptak P. Percutaneous radiofrequency cervical cordotomy : technique.J Neurosurg. 1965 ;23:639–44.C4
95.Roulaud M, Durand-Zaleski I, Ingrand P, Serrie A, Diallo B, Peruzzi P, et al.Multicolumn spinal cord stimulation for significant low back pain in failed back surgery syndrome : design of a national, multicentre, randomized, controlled health economics trial (ESTIMET Study). Neurochirurgie. 2015 ;61 Suppl 1:S109–16.C4
96.Sanford M. Intrathecal ziconotide : a review of its use in patients with chronic pain refractory to other systemic or intrathecal analgesics. CNS Drugs. 2013 ;27:989–1002.C4
97.Sano K. Intralaminar thalamotomy (thalamolaminotomy) and posteromedial hypothalamotomy in the treatment of intractable pain. Prog Neurol Surg. 1977 ;8:103.C4
98.Schuller A. Uber operative Durchtrennung der Rückenmarks-strange (Chordotomie). Wien Med Wochenschr. 1910 ;229.C4
99.Shealy CN, Mortimer JT, Hagfors NR. Dorsal column electroanalgesia. J Neurosurg. 1970 ;32:560–4.C4
100.Siegfried J. Stereotactic pulvinarotomy in the treatment of chronic intractable pain. Prog Neurol Surg. 1977 ;104–13.C4
101.Simpson EL, Duenas A, Holmes MW, Papaioannou D, Chilcott J. Spinal cord stimulation for chronic pain of neuropathic or ischaemic origin : systematic review and economic evaluation. Health Technol Assess Winch Engl. 2009 ;13:iii, ix – x, 1–154.C4
102.Sindou M. Study of the dorsal root entry zone : implications for pain surgery. [Lyon] ; 1972.C4
103.Sindou M. Microsurgical DREZotomy (MDT) for pain, spasticity, and hyperactive bladder : a 20-year experience. Acta Neurochir (Wien). 1995 ;137:1–5.C4
104.Sindou M, Maarrawi J, Mertens P. Motor Cortex Stimulation. In : Surgical Management of Pain. Thieme. Portland, Oregon : Kim J. Burchiel ; 2014. p. 366–76.C4
105.Sindou MP, Blondet E, Emery E, Mertens P. Microsurgical lesioning in the dorsal root entry zone for pain due to brachial plexus avulsion : a prospective series of 55 patients. J Neurosurg. 2005 ;102:1018–28.C4
106.Sindou MP, Mertens P, Bendavid U, Garcia-Larrea L, Mauguière F. Predictive value of somatosensory evoked potentials for long-lasting pain relief after spinal cord stimulation : practical use for patient selection.Neurosurgery. 2003 ;52:1374–83 ; discussion 1383–4.C4
107.Sindou M, Brinzeu A, Maarrawi J. Neurochirurgie de la douleur (II).In : EMC. Elsevier - Masson. 2015. (Neurologie).C4
108.Sindou M, Mertens P, Wael M. Microsurgical DREZotomy for pain due to spinal cord and/or cauda equina injuries : long-term results in a series of 44 patients. Pain. 2001 ;92:159–71.C4
109.Sindou M, Quoex C, Baleydier C. Fiber organization at the posterior spinal cord-rootlet junction in man. J Comp Neurol. 1974 ;153:15–26.C4
110.Sjöqvist O. The Conduction of Pain in the Fifth Nerve and Its Bearing on the Treatment of Trigeminal Neuralgia. Yale J Biol Med. 1939 ;11:593–600.C4
111.Slavin KV, Nersesyan H, Wess C. Peripheral neurostimulation for treatment of intractable occipital neuralgia. Neurosurgery. 2006 ;58:112–9 ; discussion 112–9.C4
112.Spiller W, Martin E. The treatment of persistent pain of organic origin in the lower part of the body by division of the antero-lateral column of the spinal cord. JAMA. 1912 ;1489–90.C4
113.Sweet WH, Wepsic JG. Controlled thermocoagulation of trigeminal ganglion and rootlets for differential destruction of pain fibers. 1. Trigeminal neuralgia. J Neurosurg. 1974 ;40:143–56.C4
114.Treede RD, Lankers J, Frieling A, Zangemeister WH, Kunze K, Bromm B. Cerebral potentials evoked by painful, laser stimuli in patients with syringomyelia. Brain J Neurol. 1991 ;114 ( Pt 4):1595–607.C4
115.Tsubokawa T, Katayama Y, Yamamoto T, Hirayama T, Koyama S. Chronic motor cortex stimulation for the treatment of central pain. Acta Neurochir Suppl (Wien). 1991 ;52:137–9.C4
116.Ubbink DT, Vermeulen H. Spinal cord stimulation for non-reconstructable chronic critical leg ischaemia. Cochrane Database Syst Rev. 2013 ;CD004001.C4
117.Wall PD, Sweet WH. Temporary abolition of pain in man. Science. 1967 ;155:108–9.C4
118.Weiner RL, Reed KL. Peripheral neurostimulation for control of intractable occipital neuralgia.Neuromodulation J Int Neuromodulation Soc. 1999 ;2:217–21.C4
119.Wertheimer P. Neurochirurgie Fonctionnelle.Masson. Paris ; 1956.C4
120.Wertheimer P, Lecuire J. [Posterior commissural myelotomy ; 107 cases]. Acta Chir Belg. 1953 ;52:568–74.C4
121.White J, Sweet W. Pain and the Neurosurgeon : A Forty-Year Experience. Springfield, Illinois : Charles C. Thomas ; 1955.C4
122.Willer JC. Comparative study of perceived pain and nociceptive flexion reflex in man. Pain. 1977 ;3:69–80.C4
123.Xu Q, Yaksh TL. A brief comparison of the pathophysiology of inflammatory versus neuropathic pain. Curr Opin Anaesthesiol. 2011 ;24:400–7.C4
124.Yaksh TL. Spinal opiate analgesia : characteristics and principles of action. Pain. 1981 ;11:293–346.C4
125.Young WB, Silberstein SD. Occipital nerve stimulation for primary headaches.J Neurosurg Sci. 2012 ;56:307–12.C4
126.Zhuo M, Wu G, Wu L-J.Neuronal and microglial mechanisms of neuropathic pain.Mol Brain. 2011 ;4:31.C4
127.Neurostimulateurs médullaires implantables : une technique de dernier recours [Internet]. Haute Autorité de Saté ; 2014.C4
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica

