 Douleur chronique.
Douleur chronique.
V. Principes physiopathologiques du processus pathologique
Les douleurs chroniques comportent majoritairement les douleurs par excès de nociception et les douleurs neuropathiques. S’ajoutent à celles-ci les douleurs dites régionales complexes.
V.1. Voies et centres nerveux de la nociception
La sensibilité douloureuse ou nociception met en jeu des structures permettant de détecter des stimulations potentiellement nocives. Il s’agit d’un “signal d’alerte”. Des systèmes inhibiteurs et facilitateurs modulent en permanence ce message nociceptif.
V.2. Voies anatomiques
- Nocicepteurs : Il sont retrouvés de manière diffuse au sein des tissus cutanés, musculaires, ostéo-articulaires et viscéraux. Il s’agit des terminaisons libres de fibres nerveuses sensibles à une stimulation nociceptive. Ils sont de deux types :
- Les mécanonocicepteurs (Stimuli mécaniques)
- Les nocicepteurs polymodaux (Stimuli mécaniques intenses, thermiques et/ou chimiques).
- Fibres périphériques : L’influx emprunte deux types de fibres :
- Les fibres myélinisées Aδ, de faible calibre, qui ont une conduction de 4 à 30m/s. Elles sont vectrices de douleur rapides et localisatrices.
- Les fibres non myélinisées C, qui ont une conduction inférieure à 2m/s. Elles sont vectrices de douleurs retardées, sourdes, moins localisées.
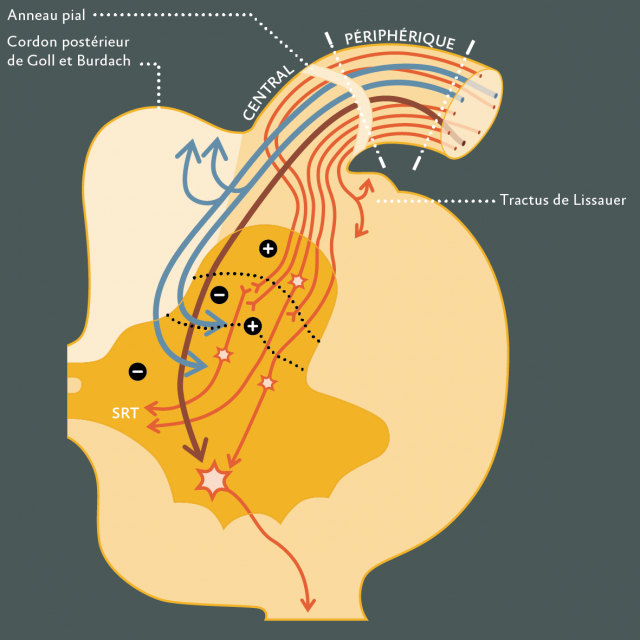
- Corne dorsale de la moëlle (Figure 1) : Il existe une organisation spatiale des fibres au sein de la zone d’entrée de la racine dorsale dans la moëlle : les fibres nociceptives se placent dans la région ventro-latérale pour se rendre, à travers le tractus de Lissauer, aux couches superficielles de la corne dorsale(102,109).
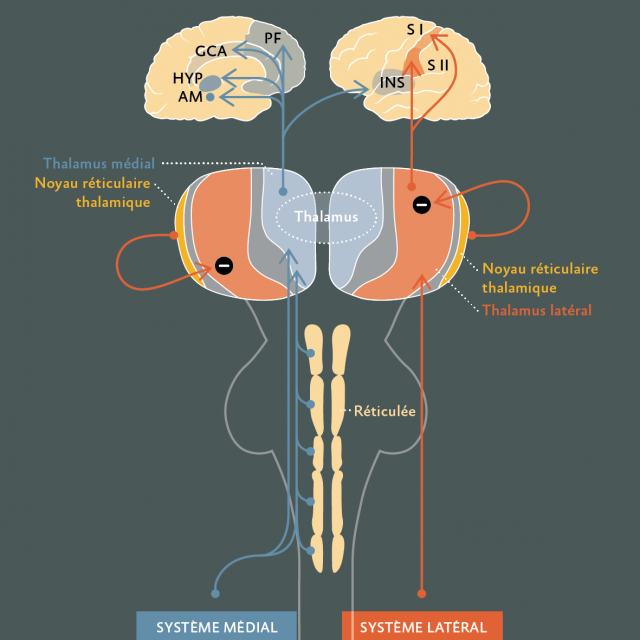
- Voies ascendantes (Figure 2) : Il existe une décussation des fibres qui croisent la ligne médiane non loin du canal épendymaire et se dirigent vers le cordon ventro-latéral controlatéral de la moëlle pour former le faisceau spino-réticulo-thalamique. Le contingent latéral correspond au faisceau néo-spino-thalamique et le contingent médial au faisceau paléo-réticulo-spino-thalamique.
- Centres supérieurs :
- Le faisceau néo-spino-thalamique, qui a une fonction plutôt discriminative et de repérage topographique de la douleur, se projette dans le noyau ventro-postéro-latéral puis vers les cortex somesthésiques primaire et secondaire.
- Le faisceau paléo-réticulo-spino-thalamique, qui permet l’évaluation de l’intensité de la douleur, se projette au niveau de la substance réticulée, au niveau des noyaux intra-laminaires du thalamus puis au niveau du cortex cingulaire, des structures limbiques, du complexe amygdalien et des aires préfrontales (ces structures correspondant à la « Pain Matrix »).
- Il existe à l’étage encéphalique, une interaction entre les projections nociceptives et les autres fonctions corticales.
-
- Figure 1
Figure 1 : Organisation de la corne dorsale de la moëlle : Chaque radicelle est formée d’un segment périphérique et d’un segment central réunis au niveau de l’anneau pial. A la périphérie, les fibres n’ont aucune systématisation particulière. Au voisinage de l’anneau pial, les petites fibres (nociceptives) se disposent à la surface de la radicelle en majorité sur le bord latéral. Au niveau du segment central, elles se regroupent latéralement pour pénétrer dans le tractus de Lissauer. Les grosses fibres destinées à la corne antérieure (myotatiques) sont au millieu et celles à destinée cordonale postérieure (sensibilité discriminative et proprioceptive) en situation médiale. Les petites fibres se terminent sur les cellules d’origine du faisceau spino-réticulo-thalamique (SRT), voie nociceptive ascendante, qu’elles activent et sur les arcs réflexes polysynaptiques des motoneurones, en particulier ceux des muscles fléchisseurs. Les grosses fibres myotatiques se projettent sur les cellules de la corne antérieure et forment les arcs réflexes myotatiques. Les collatérales courtes des grosses fibres à destinée cordonale postérieure se terminent sur les cellules SRT qu’elles inhibent. La pointe de flèche évidée montre la lésion de la DREZotomie microchirurgicale(Cf. Paragraphe dédié ci-dessous)qui pénètre de 3mm dans la profondeur dans la jonction radicullomédullaire dorsale et fait un angle de 35° à 45° selon le niveau médullaire. D’après Sindou & Al.(102,109)
- Figure 2
Figure 2 : Voies ascendantes et centres supérieurs d’intégration de la douleur :
1°)Le système latéral (néo-spino-thalamique) est superficiel dans le cordon ventro-latéral de la moelle. Il a une conduction rapide et pauci-synaptique. Il se projette somatotopiquement sur les noyaux relais VPM et VPL du thalamus puis sur le cortex somesthésique primaire SI (et SII).Il s’agit dusystème discriminatif de la sensibilité douloureuse.
2°) Le système médial (paléo-spino-réticulo-thalamique) est profond dans le cordon ventro-latéral de la moelle. Il a une conduction lente et multi-synaptique. Il a de nombreux relais dans la substance reticulée du tronc cérébral. Il se projette sur le thalamus médial (noyaux intra-laminaire et parafasciculaire). Cette voie se distribue ensuite vers l’hypothalamus, les structures limbiques, le complexe amygdalien et les aires préfrontales. L’ensemble de ce système est en charge de l’aspect affectif, cognitif et comportemental de la sensibilité douloureuse.
SI : aire somesthésique primaire ; SII : aire somesthésique secondaire ; INS : insula ; AM : noyau amygdalien ; Hyp : hypothalamus ; GCA : gyrus cingulaire antérieur ; PF : cortex préfrontal.
V.3. Mécanismes de contrôle
Le message nociceptif est constamment modulé, entraînant une perception différente d’un même stimulus d’un sujet à l’autre et d’un moment à l’autre. Les mécanismes de contrôle sont principalement les suivants :
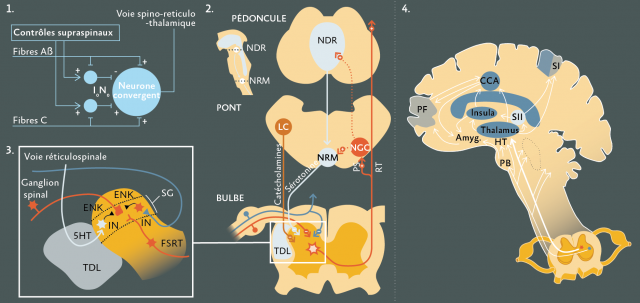
- Le système de contrôle de porte(Gate control) (Figure 3.1) est sous-tendu par les fibres myélinisées de gros calibre ; Elles exercent une action inhibitrice sur les informations nociceptives par le biais de fibres collatérales (dénommées fibres récurrentes de Ramon y Cajal).
- Le système inhibiteur descendantest constitué de voies prenant naissance dans la partie rostro-ventrale du bulbe, au niveau de sites opiacés endorphiniques et descendant vers la corne dorsale pour exercer leur effet inhibiteur par la libération de sérotonine ou de noradrénaline.(8)(Figure 3.2)
- Le système enképhalinergique de la corne dorsale spinale est constitué de petits interneurones endorphiniques. Leur mise en jeu provoque une inhibition puissante de la nociception dans la corne dorsale, comme l’a démontré le schéma d’Iversen (Figure 3.3).
- Le système du contrôle inhibiteur diffus a pour but de mettre en relief un message nociceptif en augmentant le rapport stimulus sur bruit de fond par inhibition des autres messages.(6,7)
- Figure 3
Figure 3 : Principaux systèmes de modulation et d’intégration de la douleur :
1. Théorie de la “porte” d’après Melzck et Wall(70).
2. Représentation schématique des voies inhibitrices descendantes via les voies catécholaminergiques, sérotoninergiques et les sites endomorphiniques. NDR : Noyau dorsal du raphé. NRM : Noyau raphé magnus. PSRT : paléo-spino-réticulo-thalamique. TDL : Tractus dorso-latéral. LC : Locus coeruleus. NGC : Noyau gigantocelullaire.
3. Schéma d’Iversen : Systèmes neurochimiques de la corne dorsale. SG : Substantia gelatinosa de Rolando. V : Neurones de la couche V de Rexed. IN : Interneurones. FSRT : Faisceau spino-réticulo-thalamique. TDL : Tractus dorso-latéral. ENK : Enképhaline.
4. Principales régions corticales et sous-corticales impliquées dans la perception de la douleur. SI : Aire somesthésique primaire. SII : Aire somesthésique secondaire. INS : Insula. Ht : Hypothalamus. CCA : Cortex cingulaire antérieur. PF : Cortex préfrontal. Amyg. : Amygdale. PB : Parabrachial
V.4. Douleurs nociceptives
La douleur est générée par l’excès d’afférences nociceptives dans les fibres C en lien avec les stimuli algogènes. En outre, il existe un certain nombre de phénomènes « satellites » contribuant à augmenter le mécanisme nociceptif :
- L’hyperalgésie périphériquecorrespond à une augmentation des décharges des nocicepteurs par amplification de leurs réponses aux stimuli douloureux à la suite d’un abaissement de leur seuil de déclenchement. Il s’établit un cercle vicieux neurochimique périphérique qui provoque une libération accrue de médiateurs. Ceux-ci ont des effets excitateurs et sensibilisateurs sur les nocicepteurs.
- Le réflexe de dendrite, dit « d’axone »est déclenché par la stimulation répétée des fibres afférentes primaires nociceptives. Il induit de façon rétrograde une inflammation neurogène périphérique due aux substances sécrétées en périphérie par les fibres nerveuses nociceptives : substance P (SP), calcitonine gene-related peptide (CGRP), etc. Ces substances renforcent le cercle vicieux périphérique.
- La contracture motrice réflexeà la douleur aggrave les phénomènes douloureux. L’arc réflexe se fait entre les collatérales des fibres afférentes primaires nociceptives et la corne ventrale de la moelle.
- Une hyperalgésie centralepeut également s’associer à l’excès d’influx nociceptifs périphériques, par augmentation de la décharge des neurones convergents spinaux. Ces phénomènes sont dus à des cercles vicieux neurochimiques de la corne dorsale faisant intervenir les récepteurs N-méthyl-D-aspartate (NMDA). De même, l’augmentation postsynaptique d’ions calcium aboutit à des changements géniques, créant ainsi une sensibilisation durable des neurones convergents.
V.5.Douleurs neuropathiques
Ces douleurs sont consécutives à une lésion du système nerveux sensoriel somesthésique, soit périphérique, soit central. Plusieurs mécanismes physiopathologiques ont été incriminés :
- Les décharges ectopiquessont des influx nerveux qui prennent naissance au niveau des fibres nerveuses lésées, par prolifération anormale des canaux ioniques, rendant ainsi la dépolarisation de ces neurones plus facile et même spontanée sans stimulus périphérique. Ces décharges ectopiques sont l’origine prépondérante des douleurs névromateuses.
- La prolifération anormale des récepteurs adrénergiques(type α1) au niveau des fibres afférentes primaires nociceptives rend ces fibres plus sensibles à la noradrénaline, expliquant les douleurs médiées par le système sympathique(123).
- L’atteinte des grosses fibres myélinisées Aβ, qui normalement ferment la « porte » au niveau de la corne dorsale (gate control), aboutit à une « porte » ouverte qui facilite la transmission nociceptive, expliquant ainsi certains types de douleurs neuropathiques considérées comme de désafférentation sensitive.(32,44,57)
- Les éphapsessont des néosynapses, c’est-à-dire des connexions aberrantes entre fibres porteuses de zones lésées. Cela explique certains types de douleurs provoquées par stimulation de fibres de zones adjacentes à la zone douloureuse(126).
- Au niveau de la corne dorsale de la moëlle,la stimulation des récepteurs NMDA, ainsi que la sécrétion anormale de prostaglandines et de monoxyde d’azote, peuvent entretenir un cercle vicieux de transmission nociceptive exagérée.
- L’existence d’une gliose « cicatricielle »peut également jouer un rôle en favorisant une hyperactivité spontanée des neurones locaux ; ce facteur pourrait jouer un rôle dans les douleurs d’avulsion plexique ou après lésions de la moelle épinière(123,126).
- Au niveau encéphalique, les mécanismes de la douleur sont complexes et encore mal connus. De façon simple, ils peuvent être conçus comme correspondant à une « perte du filtre » des informations somesthésiques.
Ces deux types de douleurs, nociceptives et neuropathiques, sont souvent intriqués. C’est ainsi que les lésions « cancéreuses » peuvent provoquer des douleurs non seulement par phénomènes mécaniques, ischémiques et inflammatoires - qui par l’intermédiaire d’une importante libération de substances algogènes tissulaires entraînent un excès d’influx nociceptifs - mais aussi par atteinte des nerfs périphériques. À l’inverse, certaines lésions de nerfs périphériques peuvent être à l’origine de douleurs par génération d’influx ectopiques se comportant comme un excès d’afférences nociceptives.
V.6.Syndrome douloureux régional complexe (SDRC)
Le syndrome douloureux régional complexe (SDRC ou CRPS pourcomplex regional pain syndrom, en anglais) a remplacé les termes d’algodystrophie (type 1) et de causalgie (type 2).
Le système nerveux sympathique peut participer à l’entretien de certains types de douleurs par le biais de la sécrétion de noradrénaline. La stimulation répétée des fibres afférentes primaires nociceptives provoque à leur niveau une augmentation des récepteurs à la noradrénaline, ce qui les rend plus sensibles à cette dernière.
Il s’agit d’un syndrome de diagnostic majoritairement clinique. Selon la définition de l’IASP(59), celui-ci comporte une douleur régionale, continue, spontanée ou provoquée, qui paraît disproportionnée en intensité ou en durée par rapport à l’évolution attendue de l’événement déclenchant. Cette douleur régionale ne correspond pas à un territoire nerveux périphérique (tronculaire ou radiculaire) et peut être associée à des signes cliniques moteurs, sensitifs, sudomoteurs, vasomoteurs, trophiques et moteurs qui peuvent être inconstants et variables dans le temps. Son étiologie reste discutée, mais ce syndrome se développe majoritairement après une lésion ou une chirurgie.
Le SDRC de type 1 (ex-Algodystrophie) survient en l’absence de lésion nerveuse identifiée.
Le SDRC de type 2 (ex-Causalgie) survient sur une lésion nerveuse connue.
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica

