 Douleur chronique.
Douleur chronique.
VII. Traitements
VII.1.Traitementsmédicaux
Letraitement de la douleur reposeenpremière instancesur un traitement médical adapté au type de douleur.
VII.1.1. Douleurs par excès de nociception
Leur traitement repose sur l’utilisation des antalgiques conventionnels de paliers 1, 2, 3.
- Palier 1 :
- Paracetamol : s’administre en 500mg à 1g par prise, en respectant l’intervalle entre chaque prise sans dépasser4g par jour. Le paracetamol présente une toxicité hépatique
- Nefopam : s’administre par voie parentérale (IV, IM) mais également sous-cutanée ou per os (hors AMM dans ces deux dernières voies d’administration) à une posologie de 20 à 120 mg par jour. Il est souvent utilisé en postopératoire et contre-indiqué en cas d’antécédent de convulsions, d’adénome prostatique ou de glaucome à angle fermé.
- Palier 2 :
- Codéine : chez l’adulte, la codéine est principalement associée au paracétamol, selon des rapports variables. La posologie maximale est déterminée par la dose totale de paracétamol. Les effets secondaires principaux sont : nausées, vomissements, constipation, céphalées, réactions cutanées allergiques, vertiges, somnolence. Il convient d’augmenter les posologies de manière progressive, de prévenir la constipation (laxatifs), et de traiter si besoin les nausées. La codéine peut entraîner l’apparition de troubles neurologiques, surtout chez les personnes âgées.
- Tramadol : le tramadol représente la principale alternative à la codéine dont il est proche. Il est souvent mal toléré (nausées, vertiges). Il peut être intéressant de proposer un traitement à libération prolongée avec des interdoses à libération immédiate. La posologie maximale par 24 heures est de 400 mg. Les effets secondaires sont ceux des opioïdes avec un risque plus marqué de comitialité.
- Palier 3 : La morphineestl’antalgique de palier 3 le plus employé, mais d’autresmoléculestendent de plus en plus à la remplacer (Oxycodone, Fentanyl, Hydromorphone).
- Les règles de prescription des opioïdes sont sensiblementsimilaires de l’un à l’autre : ils sont prescrits en cas d’échec des paliers 1 et 2 mais l’association à un palier 1 est souhaitable (épargne morphinique). Le traitement est instauré par titration (per os ou IV) pour évaluer la dose requise.
- Le patient doit être informé des effets indésirables (cf. paliers 2) et le traitement doit systématiquement être associé à un laxatif et un anti-émétique en cas de besoin.
- La prescription doit être précautionneuse dans le cas de douleurs chroniques non cancéreuses du fait d’un risque de tolérance puis de dépendance important.
- Chez la personne âgée et l’insuffisant rénal, il convient de diminuer les doses et d’espacer les prises.
- Le passage d’une molécule à l’autre peut permettre d’améliorer l’analgésie en limitant les effets indésirables. Il est cependant nécessaire de connaître les règles de calcul d’équianalgésie.
VII.1.2. Douleurs neuropathiques
Les douleurs neuropathiques répondent peu aux antalgiques de palier 1. Il convient d’utiliser d’autres classes médicamenteuses. Les données de la littérature concernent majoritairement les douleurs chroniques des polyneuropathiques diabétiques et les douleurs post-zosteriennes. Néanmoins, à l’exception des douleurs imputables aux neuropathies du VIH, plus résistantes, l’efficacité semble similaire dans les différentes étiologies. Ces classes thérapeutiques seront donc présentées indifféremment de la pathologie causale. Le niveau de recommandation s’appuie sur les récentes recommandations du groupe européen d’intérêt pour les douleurs neuropathiques(22). Ces données sont synthétisées dans le tableau 2.
| Première ligne | Seconde ligne | Troisième ligne | ||||||
| Classe thérapeutique | Tricycliques | Gabapentinoïdes | IRSNA(Duloxétine) | Tramadol | Capsaïcine (8%) | Lidocaïne | Opioïdes forts | |
| Gabapentine | Prégabaline | |||||||
| Indications | Centrales et Périphériques | Centrales et Périphériques | Centrales et Périphériques | Centrales et Périphériques | Centrales et Périphériques | Périphériques | Périphériques | Centrales et Périphériques |
| Posologies | 25–50 mg/j en 1 à 2prises par jour | 1200-3600mg/j en 3 prises | 150–600 mg/jen 2 prises. | 60–120mg/jen1 prise. | 200-400 mg/j en 2 à 3 prises | 1 à 4 patches pendant 30-60 minutestous les 90 jours | 1 à 3 patches pendant 12htous les jours. | Titration individuelle |
| Tolérance | Modérée – Mauvaise | Bonne | Bonne | Modérée | Modérée - Mauvaise | Bonne | Bonne | Modérée - Mauvaise |
| Effets indésirables | Dysurie, bouche sèche, Hypotension orthostatique, céphalées, troubles de l’accomodation, constipation, sueurs, somnolences, vertiges, troubles cardiaques. | Somnolence, asthénie, vertiges, nausées, anorexie, sécheresse buccale, céphalées, oedèmes périphériques, prise de poids. | Nausées, vomissements, constipation, anorexie, bouche sèche, vertiges, somnolence, insomnie, sueurs, fatigue. | Vertiges, nausées-vomissmeents, constipation, somnolence, céphalées, sécheresse buccale, dysurie, insuffisance rénale | Locaux : prurit, irritation, allergie | Locaux : Brûlures, douleur, erytheme, prurit. | Nausées-vomissmeents,anorexie, flou visuel,constipation, somnolence, céphalées, sécheresse buccale, dysurie,troubles cognitifs | |
| Précautions d’emploi | Glaucome angle étroit, obstacle urétro-prostatique, Infarctus myocardique récent, épilepsie réfractaire. | Posologies adaptées à la fonction rénale. Réduire les doses chez la personne âgée. | Insuffisance hépatique, HTA non contrôlée | Association avec IRS, IRSNA, Tricycliques. Epilepsie réfractaire. | Application sur peau saine | Application sur peau saine | Précautions d’emplois des morphiniques (Cf ci dessus) | |
| Bénéficesassociés | Dépression(>75mg/j), anxiété, troubles du sommeil | Troubles du sommeil | Troubles du sommeil et troubles anxieux | Dépression et anxiété | Douleur nociceptives etinflammatoires. | Pas d’effet systémique | Pas d’effet systémique | Douleurs nociceptives et inflammatoires |
| Coût | Faible | Modéré – Faible | Modéré – Faible | Modéré – Faible | Faible | Important | Important | Modéré - Faible |
Tableau 2 : Principaux traitements indiqués dans les douleurs neuropathiques (D’après Finnerup & Al.(32))
Première ligne de traitement :
- Antidépresseurs tricycliques : l’efficacité des antidépresseurs tricycliques dans les douleurs neuropathiques est largement démontrée avec un niveau de preuve de grade A. Ils sont efficaces sur la douleur continue et les paroxysmes mais leur effet sur l’allodynie est moins documenté. Le plus représenté de cette classe thérapeutique est l’amitriptyline. Les posologies étudiées varient considérablement (25-150mg/j) sans effet dose-réponse clairement identifié. Les antidépresseurs tricycliques présentent l’avantage d’être bon marché et d’associer un effet bénéfique sur la dépression et l’anxiété (clomipramine) mais à doses souvent supérieures à celles utilisées dans le traitement des douleurs (>75mg/j). Ils doivent être utilisés très prudemment chez la personne âgée et sont contre-indiqués en cas de glaucome à angle étroit, d’adénome de prostate et d’infarctus du myocarde récent. Ils ont l’inconvénient de présenter de fréquents etmultiples effets indésirables (dysurie, bouche sèche, hypotension orthostatique, céphalées, troubles de l’accomodation, constipation, sueurs, prise de poids, troubles cognitifs, troubles cardio-vasculaires).
- Gabapentinoïdes : prégabaline et gabapentine semblent présenter une efficacité antalgique de même niveau que celle des antidépresseurs tricycliques en entraînant moins d’effets indésirables mais moyennant un coût de traitement sensiblement supérieur. Ils sont également efficaces sur les troubles du sommeil et sur les troubles anxieux associés à la douleur (prégabaline). L’efficacité de cette classe thérapeutique semble liée à la posologie, notamment pour la prégabaline (efficacité inconstante à 150mg/j et maximale à 600mg/j). Il en va de mêmepour les effets indésirables (nausées/vomissements, anorexie, bouche sèche, vertiges, somnolence, sueurs fatigue.)Ilssemblent néanmoins sensiblement moins fréquents que dans le cas de traitements par antidépresseurs tricycliques (25% vs. 65%)(5).
- Antidépresseurs inhibiteurs de la recapture de la sérotonine et de la noradrénaline (Duloxetine) : la Duloxetine est dorénavant considérée comme un traitement de première ligne des douleurs neuropathiques. Elle est contre-indiquée en cas de pathologie hépatique et d’hypertension artérielle non traitée. Elle peut entraîner majoritairement des troubles gastro-intestinaux et des modifications du comportement. Elle présente l’avantage d’être efficace sur la dépression et les troubles anxieux.
Seconde ligne de traitement :
- Tramadol : il agit en tant qu’agoniste opioïde faible et inhibiteur de la recapture de la sérotonine et de la noradrénaline. Son avantage réside dans son action simultanée sur les douleurs par excès de nociception. Il présente donc un intérêt tout particulier dans les douleurs mixtes. Il n’est en revanche pas dénué d’effets indésirables,jusqu’à 43% d’arrêt pour effet indésirables(38), ceux-ci correspondent essentiellement aux effets des opiacés présentés précédemment. La prescription doit être particulièrement prudente chez le sujet âgé.
- Capsaïcinefortement dosée (patchs) : ils bénéficient d’une AMM dans les douleurs neuropathiques périphériques. L’avantage réside dans le peu d’effets indésirables systémique et l’efficacité prolongée :une application de 30 à 60 minutes sur la zonedouloureuse tous les 90 jours. Néanmoins l’application du patch est souvent très douloureuse et peut nécessiter l’emploi de traitements antalgiques et d’une application en milieu hospitalier.
- Lidocaïne(patchs) : l’efficacité concerne uniquement les douleurs neuropathiques périphériques. L’effet semble modéré, mais l’intérêt réside essentiellement dans l’excellente tolérance du traitement. Le patch doit être appliqué sur une peau saine.
Troisième ligne de traitement :
- Opioïdes forts :l’efficacité des opioïdes forts sur la douleur neuropathique a été prouvée dans les douleurs neuropathiques périphériques. Néanmoins, les doses nécessaires à l’obtention de cette efficacité sont importantes, et la prescription de morphine au long cours dans la douleur non cancéreuse doit toujours s’entourer de multiples précautions. Le risque d’abus est important, estimé à plus de 2,5%(90).
Traitement non médicamenteux :
- Thérapies à médiation corporelle :il existe un vaste champ de thérapies à médiation corporelles pouvant être employé face à la douleur : kinésithérapie (massage, école du dos, physiothérapie), acupuncture, électro-acupuncture, ostéopathie. Ces thérapies, à la manière des méthodes de neuromodulation, renforcent les différents contrôles inhibiteurs de la douleur. Elles permettent également de renforcer la relation soignant-malade.(9)
- Psychothérapie : la psychothérapie notamment cognitivo-comportementale peut être proposée en cas de douleurs neuropathiques, en particulier en cas de comorbidités anxiogènes et de difficulté d’ajustement à la douleur (Grade B de recommandations(67)).
- Hypnose : l’hypnose est une technique ancienne de plus de 2000 ans couvrant différentes pratiques visant à induire un état de conscience modifié. Ses mécanismes physiologiques sont étudiés de manière approfondie sur le plan scientifique. Ses effets thérapeutiques sont difficiles à évaluer, mais il semble exister une réelle efficacité notamment en anesthésie ou dans la prise en charge des colopathies fonctionnelles. L’auto-hypnose peut également se révéler un atout majeur dans la prise en charge des douleurs chroniques.(31)
- Neurostimulation transcutanée (TENS) : la neurostimulation transcutanée est efficace en cas de douleurs neuropathiques périphériques focales comme dans les neuropathies diabétiques et les lésions post-traumatiques(Grade B de recommandations(67). Il s’agit également d’un traitement de choix dans les Syndromes douloureux régionaux complexes, en plaçant les électrodes de part et d’autre de l’interligne articulaire. Dans ce cas, le traitement doit intervenir le plus tôt possible, avant fixation de l’articulation.
- Stimulation magnétique transcrânienne répétititve (rTMS) : si son effet reste modéré et discuté(83), la rTMS du cortex précentral semble efficace en cas de douleurs neuropathiques périphériques et centrales. Elle bénéficie d’un niveau de recommandation de grade A(53).
VII.2.Traitements chirurgicaux
VII.2.1. Traitements lésionnels (figure 5)
Figure 5 : Principales interventions d’interruption des voies nociceptives : sympathectomie (S), neurotomie (N), radicotomie dorsale (R), Drezotomie (DREZ), myélotomie commissurale postérieure (MC), cordotomie anterolaterale (C), tractotomie spinothalamique pédonculaire (TST), thalamotomie stéréotaxique (T), lobotomie préfrontale et variantes (L). TH : thalamus ; VPL : noyau somesthésique ventro-postéro-lateral. D’après Sindou & Al.(107)
Intervention d’interruption des nerfs sensitifs
Le risque principal de toute neurotomie est l’apparition d’un névrome et/ou d’une anesthésie douloureuse. On lui préfère donc un simple blocage du nerf par un anesthésique local et - si le test est positif - une « infiltration » à son voisinage par alcool ou phénol, ou encore une thermocoagulation percutanée. Les thermocoagulations les plus fréquemment pratiquées sont celles du nerf occipital pour certaines névralgies d’Arnold ou celle des nerfs articulaires rachidiens pour les douleurs du syndrome des articulaires postérieures lombaires.
Interventions sur le système sympathique
Elles ont été développées par Leriche en France et White auxÉtats-Unis, et ne sont plus que très peu pratiquées. Elles gardent cependant des indications dans certaines douleurs d’origine viscérale ou encore en cas d’importants troubles vasomoteurs responsables ou satellites de douleurs rebelles. Les sympathectomies peuvent être pratiquées à différents niveaux, par voie percutanée ou endoscopique :
- Pour le membre supérieur, au niveau de la chaîne thoracique paravertébrale du deuxième au quatrième ganglion, ou au niveau du ganglion stellaire, par blocs percutanés répétés d’un anesthésique local. Il est à noter que la destruction de ce dernier exposerait au risque de syndrome de Claude Bernard-Horner ;
- Pour le membre inférieur, au niveau du plexus sympathique lombaire ;
- Pour l’abdomen et les viscères, au niveau du système splanchnique, et pour les cancers pancréatiques avec douleurs solaires, au niveau du plexus cœliaque.
Interventions sur les racines spinales
Radicotomies percutanées chimiques ou thermiques
Les premières radicotomies chimiques, faites par injections sous-arachnoïdiennes, ont été réalisées à l’alcool en 1930 par Dogliotti. Du fait de sa grande diffusibilité et des nombreuses complications induites, il a été abandonné au profit du phénol. Le mélange au phénol d’une solution glycérinée (pour le rendre moins agressif) ou de pantopaque (pour suivre sa migration sous radioscopie) permet d’obtenir un produit plus lourd que le liquide cérébrospinal (LCS) et assez peu diffusible, donc de maniement plus facile(65). L’injection peut s’accompagner de douleurs violentes et de céphalées traduisant une réaction méningée, nécessitant l’emploi d’antalgiques puissants dans la période postopératoire. Comme l’ont montré des études histopathologiques, les lésions semblent non spécifiques d’un type de fibres. Cette méthode semble présenter une bonne efficacité mais au prix de complications multiples : les paresthésies et les atteintes motrices sont le plus souvent transitoires mais les complications génitosphinctériennes, elles, sont le plus souvent durables. Ce traitement est à réserver aux affections cancéreuses. Il est particulièrement utile chez les malades fragiles à espérance de vie brève, en particulier dans les cancers périnéopelviens comportant déjà des troubles génitosphinctériens sévères.
Radicotomies dorsales chirurgicales
Les radicotomies dorsales consistent en l’interruption de la racine dorsale sensitive. Elles impliquent une section des fibres sensitives somatiques mais aussi des afférences viscérales et vasculaires qui les rejoignent à partir des ganglions latérovertébraux par les rameaux communicants gris. Un territoire somatique métamérique dépend de trois racines au moins ce qui oblige à réaliser des radicotomies étendues pour être efficaces. Au niveau cervical ou lombosacré, la réalisation de radicotomies étendues risquent d’entraîner une perte fonctionnelle du membre par ataxie et anesthésie complète, et au niveau sacré des troubles génitosphinctériens sévères. Les indications doivent être réduites aux seules douleurs d’origine cancéreuse et topographiquement limitées. Dans les cancers périnéopelviens, lorsqu’il existe une perte totale des fonctions génitosphinctériennes, il peut être fait appel à une méthode simplifiée qui consiste à ligaturer en masse le fourreau dural au-dessous de l’émergence des gaines durales des racines S1, par un abord interlamaire limité L5-S1(18).
Quelle que soit la technique envisagée, il peut être utile d’effectuer un bloc anesthésique local radio- ou scan-guidé en préalable à une radicotomie pour en prévoir l’effet antalgique et préciser l’étendue des sections à réaliser.
Interventions d’interruption des nerfs crâniens sensitifs de l’extrémité céphalique
Les interventions lésionnelles sur les nerfs crâniens sont fréquemment employées pour le traitement des névralgies essentielles, surtout trigéminales - de loin les plus fréquentes - mais également vago-glossopharyngiennes. Elles sont réalisées lorsque l’IRM ne montre pas de conflit neuro-vasculaire ou lorsque la décompression vasculaire micro-chirurgicale ne peut être pratiquée pour quelque raison que ce soit (Figure 6).
L’interruption des nerfs crâniens sensitifs peut être réalisée, soit par section microchirurgicale dans l’angle pontocérébelleux, soit par thermocoagulation percutanée au moyen d’une électrode introduite sous contrôle fluoroscopique respectivement par le foramen ovale pour le nerf V(113)(Figure 7.1) et par le foramen jugularis pour les nerfs IX-X(50)(Figure 7.2). Ces interventions ont déjà fait l’objet d’un chapitre spécifique dans l’encyclopédie neurochirurgicale.
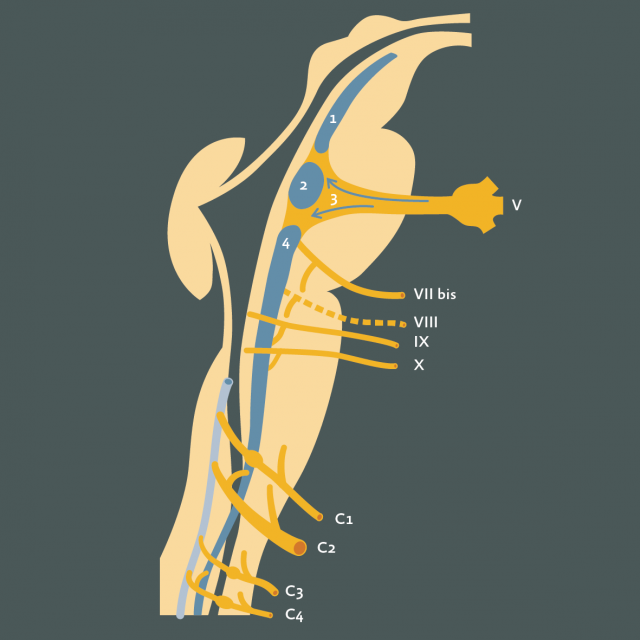
Figure 6 : Voies cervico-céphalique et de la face : radicotomies des nerfs crâniens : 1. Voies de la sensibilité cervico-céphalique. Le V et le VIIbis innervent la face. Le IX et le X innervent le carrefour aérodigestif. Les racines dorsales cervicales supérieures innervent la région cervico-céphalique. Le contingent sympathique cervical et le ganglion stellaire sont représentés en vert. 2. Photographie sous magnification par microscope opératoire montrant le V et le complexe acoustico-vestibulo-facial. 3. De la même manière, les nerfs IX, X et XI pénétrant dans le foramen jugulaire (FJ) (IX = nerf glossopharyngien ; X = nerf vague ; XI = nerf accessoire ; VB = Artère vertébro-basilaire ; Ch. Ph. = Plexus Choroïde ; PICA = Artère cérébelleuse postéro-inférieure. 4. Vue schématique des nerfs de l’angle ponto-cérébelleux droit après écartement du cervelet (C) médialement. Les nerfs sensitifs (V pars major, VIIbis, IX et radicelles sensitives du X) ont été sectionnés. T : tente du cervelet .
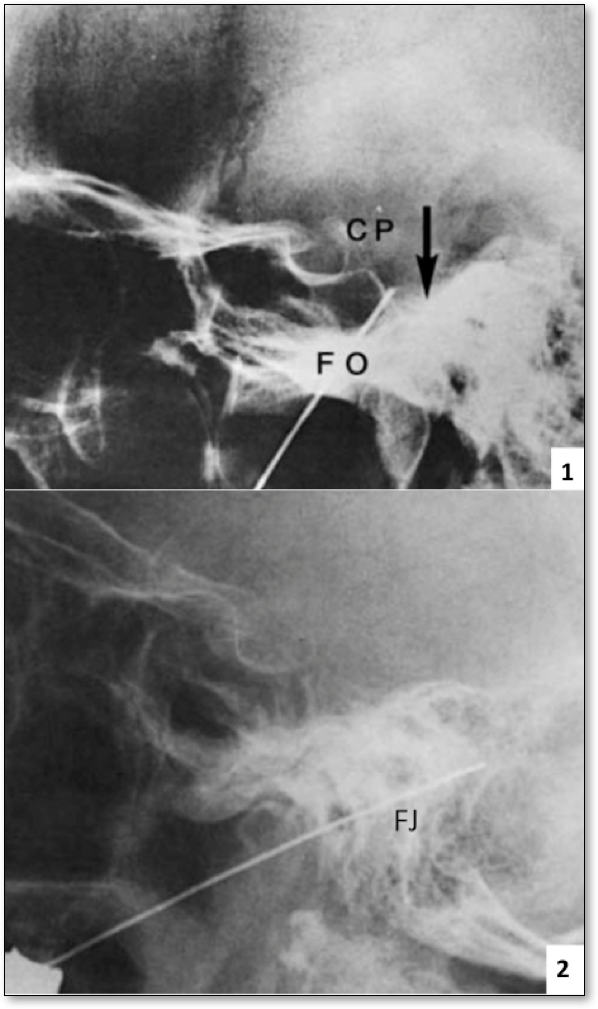
Figure 7 : 1. Contrôle fluoroscopique de profil durant une thermocoagulation percutanée du trijumeau, FO : foramen ovale, CP : clinoide postérieure. L’électrode est introduite jusqu’au bord supérieur du rocher à travers le foramen ovale jusqu’au cavum de Meckel ou siège le ganglion de Gasser.
2. Contrôle fluoroscopique de profil durant une thermocoagulation percutanée du glossopharyngien et du vague sensitif. L’électrode est introduite jusque dans le foramen jugulaire (FJ) au niveau de sa pars nervosa où passent le IX en avant et le X en arrière.
Interventions sur la zone d’entrée des racines dorsales dans la moelle (DREZotomie)
Cette technique a pour objectif de détruire des circuits nociceptifs dans une région la DREZ (Dorsal Root Entry Zone) considérée comme un important niveau de modulation de la sensibilité et de la nociception par la théorie du gate-control(70)(Figures 1 et 8). Elle est appropriée dans des douleurs segmentaires secondaires à une désafférentation sensitive et/ou à des remaniements tissulaires de la racine spinale et de la corne dorsale de la moëlle. La DREZotomie microchirurgicale (DTM)(102,109)vise à détruire, par microcoagulation sous importante magnification optique, les circuits nociceptifs ainsi que les neurones de la corne dorsale devenus hyperactifs et donc générateurs de ces douleurs neuropathiques(32,33,43,44,57,58,72)(Figure 8). Cette technique permet de préserver au moins en partie les voies à destination de la colonne dorsale évitant l’anesthésie complète et le risque d’apparition d’un syndrome d’anesthésie douloureuse(42).
Les indications sont restrictives :
Les douleurs d’origine cancéreuse peuvent relever de la DTM lorsqu’elles sont de topographie limitée : C’est entre autres le cas du syndrome de l’apex thoracique de Pancoast-Tobias (où elle est généralement réalisée de C7 à Th3) ou du plancher périnéal avec perte des fonctions génito-sphinctériennes dépendant des racines sacrées. L’intervention permet le contrôle de la douleur dans les quatre cinquièmes des cas pour une survie de un an et demi en moyenne(103).
Dans les douleurs neuropathiques, elle peut être considérée comme le standard de traitement des douleurs des avulsions radiculaires et des douleurs segmentaires des lésions de la moelle épinière(103).
Quatre-vingt-dix pour cent des patients porteurs de lésions traumatiques du plexus brachial, ou éventualité plus rare, du plexus lombosacré, de niveau préganglionnaire (avulsion radiculaire), développent des douleurs réfractaires. La chirurgie doit être réalisée au niveau des segments avulsés et étendue aux racines adjacentes si les douleurs s’étendent à leur territoire. La revue de la littérature montre une sédation complète de la douleur à long terme dans 58 à 87 % des cas selon les auteurs(105).
Plus d’un tiers des blessés médullaires développent des douleurs chroniques en particulier lorsque les lésions siègent au niveau du cône médullaire et de la queue de cheval : Parmi ces douleurs il convient de différencier les douleurs segmentaires (segments lésés) des douleurs sous-lésionnelles. La DREZotomie n’améliore que les douleurs segmentaires.
La DREZotomie trouve d’autres indications dans les douleurs secondaires à des lésions des nerfs périphériques, les SDRC de type II, les douleurs post-radiques et les douleurs post-zosteriennes, à condition que les douleurs soient majoritairement paroxystiques et/ou allodyniques et bien entendu que la stimulation médullaire faite en première intention ait échoué(106).
La DREZotomie peut également se révéler bénéfique dans les hyperspasticités douloureuses du fait de son effet puissamment hypotonisant en interrompant les afférences nociceptives et myotatiques tonigènes(19,91).
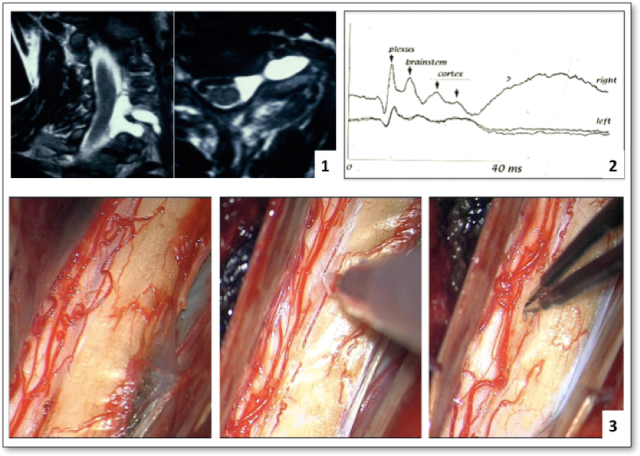
Figure 8 : DREZotomie microchirurgicale cervicale dans le cadre d’une avulsion du plexus brachial. 1. IRM en séquence T2 mettant en évidence des pseudo-méningocèles cervicales liées à l’avulsion plexique. 2. PES par stimulation du nerf médian montrant une interruption de niveau plexique. 3. Constat peropératoire montrant clairement l’avulsion radiculaire (gauche), l’incision du sillon dorso-latéral (milieu), puis les microcoagulations à l’aide d’une pince bipolaire graduées, jusqu’à 3 à 4 mm de profondeur (droite).
Myélotomies commissurales et centromédullaires
Les myéotomies commisurales postérieures consistent en une interruption de la décussation des fibres spino-réticulo-thalamiques par une incision longitudinale de la commissure blanche ventrale au fond du sillon dorsal médian postérieur. Elle est réalisée sur plusieurs métamères, choisis en fonction des segments douloureux. Cette technique a majoritairement été utilisée au niveau de la moëlle lombaire pour des douleurs néoplasiques(120). Elle se révèle particulièrement dangereuse au niveau cervical.
Il a été proposé une myélotomie centromédullaire percutanée par Hitchcock dans les années 1970(37). Celle-ci vise à interrompre la partie profonde des voies spino-réticulaires ascendantes. Cette myélotomie se destine aux douleurs cancéreuses du tronc et/ou des membres avec déficit constitué. L’objectif lésionnel est le centre de la moelle à la jonction occipito-cervicale. Celui-ci est atteint sous guidage fluoroscopique et monitoring électrophysiologique. L’effet est en général limité dans le temps.
Cordotomie antérolatérale
Elle consiste en la section de la voie paléo-spino-réticulo-thalamique, laquelle est responsable de l’intensité douloureuse. Cette voie étant profondément située dans le cordon antéro-latéral médullaire, l’intervention consiste en une interruption de ce cordon qui peut être réalisée de différentes manières (abord direct microchirurgical ouvert, abord percutané avec électrocoagulation) (Figure 9). L’objectif est donc d’obtenir une analgésie de l’hémicorps controlatéral au dessous du niveau de section.
Cette technique est probablement l’une des techniques de chirurgies lésionnelle de la douleur qui a été le plus utilisée. Elle a été imaginée à la fin du XIXe siècle par Schuller(98)et Spiller(112), puis reprise aux niveaux cervico-thoracique puis cervical haut. Enfin, une méthode percutanée par électrocoagulation a été proposée par Rosomoff en 1965(94).
Les deux techniques de cordotomie antérolatérale les plus utilisées sont :
- La méthode percutanée : Par voie latérale au niveau C1-C2, par guidage radiographique et électrophysiologique.
- La méthode microchirurgicale par voie interlamaire au niveau cervico-thoracique pour les douleurs de la moitié inférieure du corps, ou encore cervical haut pour les douleurs de la moitié supérieure. Son efficacité est limitée dans le temps, avec un maintien de l’effet antalgique à plus d’un an chez seulement 60% des patients.(66). Ses effets secondaire sont multiples et fréquents : cette intervention expose à des risques de dysautonomie, de troubles respiratoires et génito-sphinctériens du fait de la présence des fibres concernées dans le tractus intermediolateralis(71). La bilatéralité du geste augmente le risque de troubles génito-sphinctériens, dysautonomiques et respiratoires. Au dessus de C5 elle expose à une paralysie diaphragmatique homolatérale. La cordotomie pose le problème du niveau de section et de son uni- ou bi-latéralité. Le niveau de section doit tenir compte de la hauteur nécessaire à la décussation du faisceau spino-thalamique, et de l’abaissement possible du niveau d’analgésie dans les mois suivant l’intervention.
- Figure 9
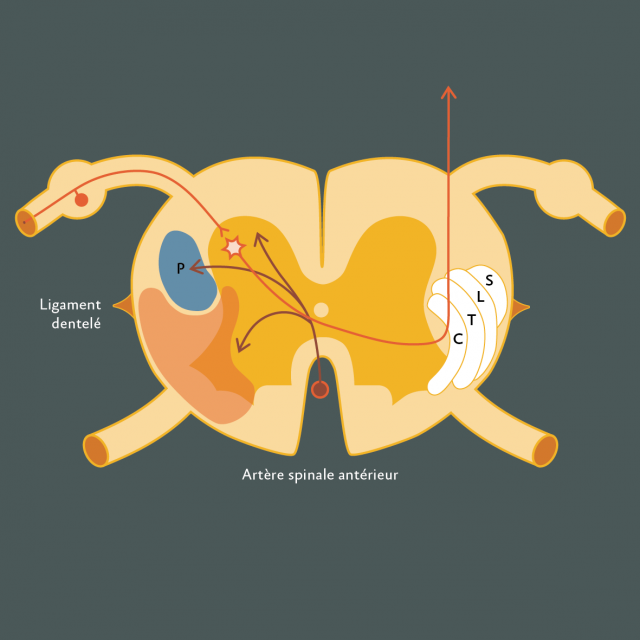
Figure 9 : Schéma anatomique de la cordotomie antérolatérale : A droite, disposition des fibres du faisceau spino-réticulo-thalamique d’après Walker selon leur provenance sacrée (S), lombaire (L), thoracique (T) et cervicale (C). A gauche, en orange, la section du quadrant antéro-latéral permettant l’obtention d’un effet antalgique. Cette section doit être profonde pour intéresser le faisceau paléo-spino-réticulo-thalamique, voie responsable de l’intensité douloureuse de la sensation.
La cordotomie antéro-latérale par abord direct posterieur implique après l’ouverture durale postérolatérale la désinsertion durale du ligament dentelé pour exposer le quadrant antérolatéral de la moelle jusqu’à l’émergence des racines antérieures. La pie-mère est ensuite incisée à l’aide d’un microbistouri depuis l’insertion piale du ligament dentelé jusqu’à l’émergence de la racine antérieure. La partie profonde du quadrant antérieur est détruite au moyen d’un crochet, mousse pour diminuer le risque de blesser l’artère spinale antérieure et ses branches sulco-commissurales ou d’entraîner une lésion du faisceau pyramidal (P) immédiatement postérieur.
Tractotomie spinothalamique mésencéphalique
Elle consiste en une coagulation sous-thalamique du faisceau spinothalamique par voie stéréotaxique (Figure 10).
Les meilleures indications de cette technique semblent être les douleurs cervico-céphaliques des cancers ORL évolués. L’intervention obtient 80% d’efficacité(10)et ne présente pas les inconvénients respiratoires de la cordotomie antérolatérale haut située. Cependant, elle peut se compliquer de dysesthésies et de troubles oculomoteurs si la cible est dépassée.
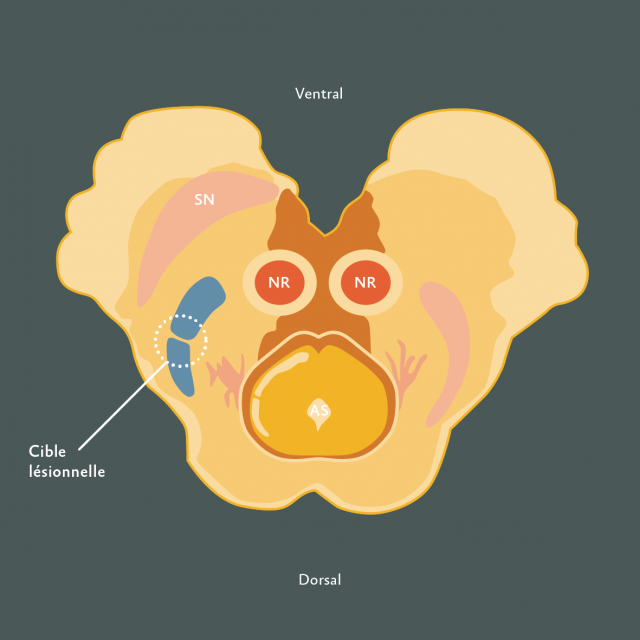
- Figure 10
Figure 10 : Représentation de la cible lésionnelle pour une tractotomie mésencéphalique stéréotaxique). Noyaux rouges (NR), Substance noire (SN), Aqueduc de Sylvius (AS).
Interventions cérébrales
Interventions sur le diencéphale
Plusieurs interventions stéréotaxiques ont été proposées sur des cibles diencéphaliques : l’hypothalamotomie postéromédiane(21,100)et la thalamolaminotomie qui consiste en une destruction des noyaux intralaminaires postérieurs du thalamus(21,100). Ces méthodes appartiennent davantage au domaine de la psychochirurgie et ses sont révélées dangereuses et peu efficaces(97).
Interventions sur le lobe frontal
D’indications exceptionnelles, les lobotomies frontales et leurs différentes modalités appartiennent au domaine de la psychochirurgie. Elles modifient l’attitude du malade vis à vis de sa douleur plus qu’elles n’en diminuent sa perception.(77)
Interventions sur l’hypophyse
Elles sont principalement indiquées en cas de douleurs cancéreuses. Pratiquées initialement par voie sous-frontale puis abandonnées, elles bénéficient d’un regain d’intérêt avec l’avènement des voies transsphénoïdales ou encore d’autres types d’interventions (stéréotaxie, implantation d’isotope radioactif, thermocoagulation, injection d’alcool, et plus récemment radiochirurgie).
Les hypophysectomies se sont révélées particulièrement efficaces sur les douleurs de métastases, en particulier osseuses, notamment en cas de cancers hormonodépendants.
VII.2.2.Pharmacothérapie intrathécale
La pharmacothérapie intrathécale débuta par la morphinothérapie dans les années 1980(106,106). D’autres molécules ont depuis été utilisées telles que le Baclofène et le Ziconotide(89,96).
Les indications sont essentiellement les douleurs néoplasiques, notamment dans le cas de pathologies étendues. Elles peuvent cependant parfois s’appliquer aux douleurs neuropathiques notamment médullaires.
La technique d’administration consiste en la mise en place sous contrôle scopique d’un cathéter dans l’espace sous-arachnoïdien. Celui-ci est la plupart du temps inséré au niveau lombaire pour remonter jusqu’à la jonction thoraco-lombaire. Il est relié à un réservoir implanté sous-cutané sur lequel peut être branchée une pompe externe, ou encore une pompe implantée programmable (Figure 11).Ces pompes sont programmables et leur débit est ajustable. Elles nécessitent d’être changées lorsque la batterie est épuisée.
Le produit le plus utilisé est la Morphine en particulier pour les douleurs d’origine cancéreuse. Elle est administrée à des doses environ 100 fois inférieures aux doses intraveineuses et 300 fois inférieures aux doses orales. Il est souvent observé un phénomène de tolérance impliquant la nécessité d’une augmentation progressive des doses. Néanmoins, il est obtenu des taux de contrôle de la douleur de près de 80% par la Morphine et de près de 95% avec d’adjonction d’anesthésiques locaux.(34,79,89).
Le Ziconotide est un bloqueur des canaux calciques voltage-dépendants de type N. Il réalise un blocage important des influx nociceptifs au niveau médullaire. Cela rend son usage adapté aux douleurs neuropathiques centrales médullaires.(96)
Le Baclofène intrathécal est très largement utilisé dans le traitement de la spasticité. Il se révèle également efficace sur les douleurs imputables aux contractures de la spasticité, et dans 30% des cas sur les douleurs neuropathiques associées aux troubles spastiques.
Les complications liées à ce type de chirurgie sont :
- les infections de matériel : 5 à 8%(34). Elles nécessitent le retrait du matériel et une antibiothérapie prolongée.
- les migrations ou désadaptation du montage. Elles nécessitent une reprise chirurgicale. Les complications imputables au type de traitement sont les suivantes :
- Concernant la Morphine, les surdosages sont rares si l’administration du produit est contrôlée. Les effets indésirables sont les mêmes que ceux de la morphine par voie systémique : Nausées, vomissements, prurit, troubles digestifs, et peuvent aller jusqu’aux troubles respiratoires et troubles de conscience en cas de surdosage important. Il est à noter que de grandes concentrations de morphine peuvent entraîner des granulomes sous-arachnoïdiens au niveau de l’extrémité distale du cathéter.
- Les effets secondaires du Ziconotide sont dominés par des troubles somesthésiques ou des troubles des fonctions supérieures pouvant aller jusqu’aux hallucinations.
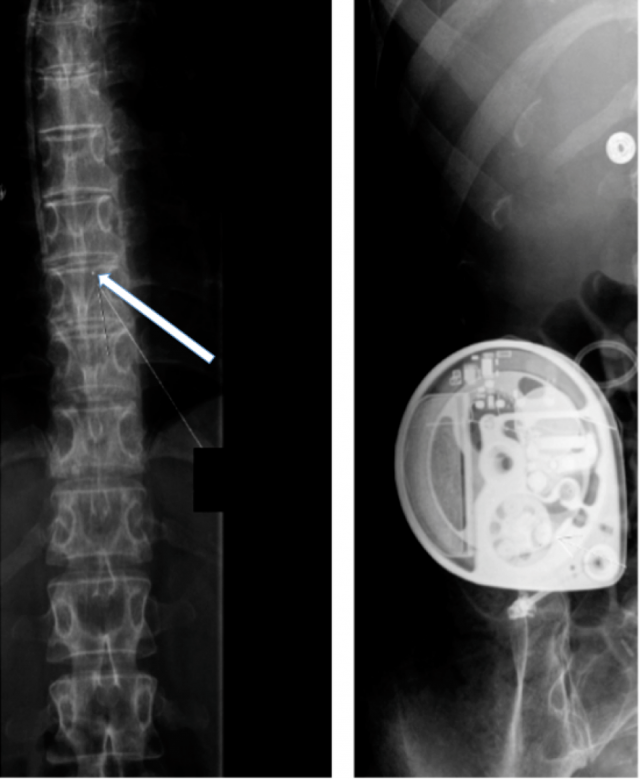
Figure 11 : Pharmacothérapie intrathécale : Clichés post-opératoires montrant, à gauche, un cathéter intrathécal en regard du niveau T9-T10 relié à une pompe programmable implantable en région sous-cutanées sus-aponévrotique (à droite).
VII.2.3.Interventions de neuromodulation
Il s’agit de techniques variées dont l’objectif est de renforcer les différents contrôles inhibiteurs de la douleur (Figure 12). La neurostimulation transcutanée et la stimulation médullaire se fondent sur la théorie de la porte de modulation médullaire(70,99). La stimulation cérébrale profonde du complexe VPL-VPM, quant à elle, repose sur la théorie de Head et Holmes(36)du contrôle thalamique de la douleur selon lequel les voies lemniscales ont un effet inhibiteur sur les voies extralemniscales. Enfin, la stimulation corticale du cortex précentral proposée par Tsubokawa(115)reste incomplètement expliquée sur le plan de son rationale.
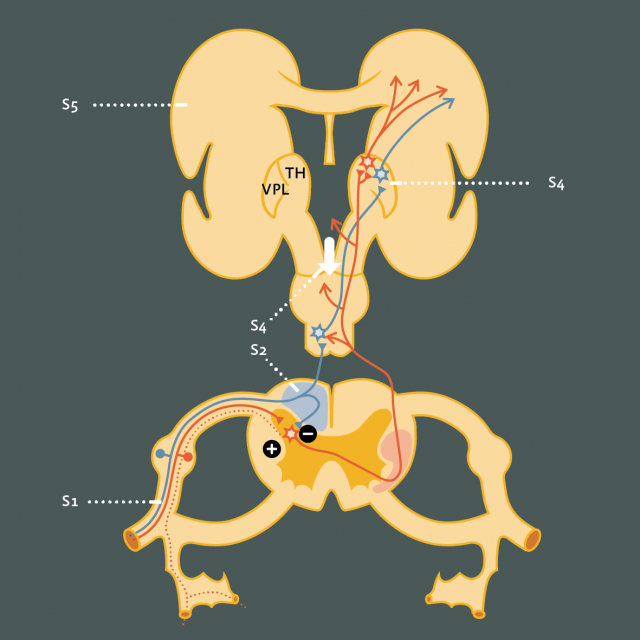
- Figure 12
Figure 12 : Différentes cibles de neuromodulation : Stimulation des grosses fibres afférentes primaires des nerfs périphériques et des racines spinales (S1), des voies cordonales dorsales (S2), du noyau VPL du thalamus (S3), de la substance grise périaqueducale ou de l’hypothalamus postérieur (S4), du cortex moteur (précentral) (S5).
Stimulation transcutanée
Il s’agit du premier stade de stimulation à visée antalgique :
Des électrodes sont appliquées sur la peau et reliées à un générateur dont le patient ajuste l’intensité et la fréquence de stimulation. La qualité du placement des électrodes est primordiale(60). Elles doivent appliquées en regard du tronc nerveux correspondant au territoire douloureux. Cela doit permettre de générer des paresthésies dans la totalité du territoire du nerf stimulé. Dans le cas d’une algodystrophie articulaire, les électrodes sont placées de part et d’autre de l’interligne articulaire.
Cette stimulation peut être initiée en ambulatoire, mais la quantité d’explications et le contrôle du bon fonctionnement peuvent nécessiter une (courte) hospitalisation.
Ce type de stimulation se révèle particulièrement efficace sur les algodystrophies débutantes, et certaines douleurs neuropathiques par lésions nerveuses périphériques(48).
Stimulation des nerfs périphériques
Cette modalité de stimulation a longtemps été abandonnée pour être reprise récemment dansdeux principales topographies.
- La stimulation du nerf grand occipital(C2) : Le nerf grand occipital correspond la branche sensitive de la racine C2. Il est en charge de l’innervation sensitive du scalp postérieur et de la région occipito-cervicale. Ses afférences convergent sur le noyau spinal. Ce dernier reçoit également des afférences multiples, notamment du Trijumeau (complexe trigémino-cervical) mais également du nerf facial (VII), glossopharyngien (IX), et des premières racines cervicales (Figure 14a). La stimulation du nerf grand occipital est une méthode de neuromodulation dédiée au traitement des céphalées et douleurs cranio-faciales résistantes. Une électrode est placée de manière sous-cutanée et sus-aponévrotique dans la région occipitale (Fig. 13) et connectée à un générateur implantable. Ses complications sont de gravité modérée et consistent principalement en des migrations d’électrodes et jusqu’à 3% d’infections obligeant au retrait du matériel(17,23). Les indications de la stimulation occipitale sont de 5 types principaux :
- Les névralgies occipitales : Développée initialement dans cette indication, elle se révèle efficace et peu invasive. Cette méthode de neuromodulation peut être envisagée comme traitement chirurgical de première intention en cas d’échec des traditionnelles infiltrations par anesthésiques locaux. Les résultats de la stimulation dans cette indication montrent des taux de succès pouvant aller de 70 à 100% et ce de manière prolongée dans le temps(111,118).
- Les algies vasculaires de la facechroniques réfractaires(23) : Il s’agit d’un type extrêmement sévère de céphalées primaires (selon la classification IHS(35)). Elle appartient au groupe des céphalées “Trigémino-autonomiques” et ses mécanismes physiopathologiques restent mal connus. Elle semble liée à l’activation d’une boucle trigémino-autonomique (Figure 14b) déclenchée par des afférences hypothalamiques postérieures (expliquant le caractère nychtéméral et saisonnier des crises). Il existe des convergences du nerf grand occipital sur le noyau trigéminal spinal par le biais de la racine C2 et du système trigémino-cervical. Celles-ci permettent probablement l’efficacité de la stimulation. Le niveau de preuve obtenu reste partiel et des essais thérapeutiques sont en cours. Les séries de cas rapportées montrent une diminution de la fréquence des crises de 50% chez près de 70% des patients.(23,125).
- Les migraines chroniques :La migraine chronique a été décrite récemment dans la classification de l’IHS(35). Son traitement chirurgical est majoritairement constitué de la stimulation des nerfs occipitaux. Plus de 500 cas ont été publiés au sein d’essais contrôlés et d’études ouvertes(17). Néanmoins, le niveau de preuve reste insuffisant et plusieurs de ces essais cliniques contrôlés n’ont pas réussi à montrer de façon formelle l’efficacité de la stimulation des nerfs occipitaux dans cette indication.
- Les douleurs trigéminales neuropathiques :Il s’agit d’uneapplication potentielle pour la neuromodulation du système trigéminal, en raison des convergences des afférences des nerfs occipitaux (C2 en particulier) sur le noyau spinal du V.
- Les céphalées cervicogéniques :elles se manifestent par des céphalées unilatérales, à point de départ occipital mais irradiant jusqu’au front, et sont déclenchées par la pression cervico-occipitale et/ou certaines postures du rachis cervical. Dans leurs formes pharmacorésistantes, elles peuvent faire l’objet de stimulation des nerfs occipitaux. Il ne s’agit encore une fois que de séries de cas rapportés(4).
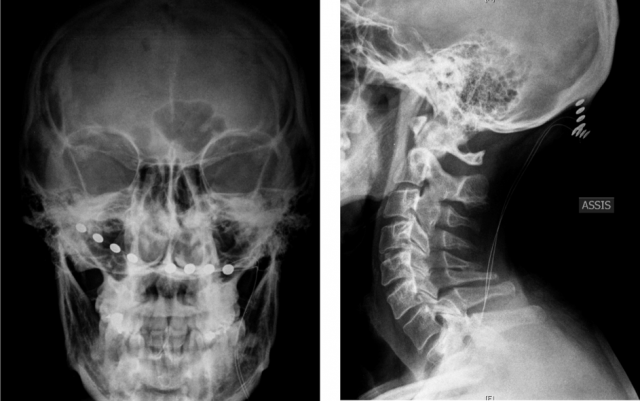
Figure 13 : Radiographies post-opératoires d’électrodes de stimulation sous-cutanées implantées le long des nerfs occipitaux et reliés à un stimulateur implanté en région pectorale.
- Figure 14A
Figure 14 : A. Mise en évidence des multiples convergences des afférences sensitives des nerfs crâniens facial (VII), cochléo-vestibulaire (VIII), glosso-pharyngien (IX), vague (X) et des quatre premières racines cervicales (C1 à C4) vers le noyau spinal du nerf trijumeau (V). Ces convergences expliquent l’efficacité de la stimulation du nerf grand occipital (racine C2) dans ses différentes indications. 1. Noyau mésencéphalique trigéminal ; 2. Noyau sensitif principal trigéminal ; 3. Tractus spinal trigéminal ; 4. Noyau spinal trigéminal.
- Figure 14B
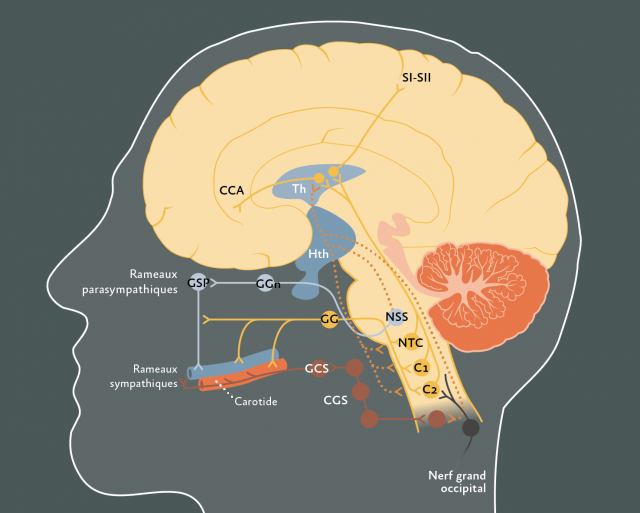
B. Eléments de physiopathologie de l’Algie Vasculaire de la face (et autres céphalées trigémino-autonomiques). Activation d’une boucle trigémino-autonomique et des voies parasympathiques (par le biais du noyau salivaire supérieur et du ganglion sphéno-palatin). Cette activation est probablement déclenchée par un générateur situé dans la substance grise hypothalamique postérieur. CCA = Cortex Cingulaire Antérieur ; Th = Thalamus ; Hth = Hypothalamus ; S1 ET S2 = Aire somesthésique primaire et secondaire, zone de projection des sensations nociceptives ; GSP = Ganglion Sphéno-Palatin ; GGn = Ganglion géniculé ; NSS = Noyau Salivaire Supérieur ; V = Nerf Trijumeau ; NTC = Noyau Trigéminal Caudal ; GG = Ganglion de Gasser ; CGS = Chaîne Ganglionnaire Sympathique cervicale ; GCS = Ganglion Cervical Supérieur.
- La stimulation des nerfs sous-cutanés lombaires : Elle peut être envisagée pour les lombalgies à forte composante. La branche postérieure de la racine nerveuse prend en charge l’innervation des processus articulaires postérieurs ainsi que des masses musculaires paravertébrales et des téguments. Toujours selon la théorie du contrôle de porte, la stimulation des grosses fibres Aβ par ce biais permettrait l’inhibition des fibres Aδ et C. L’importances des anastomoses nerveuses existant à ces niveaux permettrait la couverture de plusieurs métamères(76,78).
Stimulation médullaire
L’effet présumé de la stimulation médullaire est l’activation des fibres afférentes myélinisées de gros calibre primaires au niveau des colonnes dorsales de la moelle(74). Il s’y ajoute des mécanismes neurochimiques, notamment une inhibition des acides aminés excitateurs et une activation de la neurotransmission GABA-ergique de la corne dorsale(56).
L’efficacité de la stimulation médullaire dans les douleurs neuropathiques est dépendante de la fonctionnalité des fibres cordonales postérieures. Une lésion de ces voies située au niveau radiculaire, centralement au ganglion spinal, ainsi qu’au niveau médullaire augmente de façon importante le risque d’échec(106)(Figure 15). En sus des constations cliniques et radiologiques, le temps de conduction central (TCC) des potentiels évoqués somesthésiques permet de s’assurer de l’intégrité des colonnes dorsales. Il est un important prédicteur de l’efficacité de la stimulation médullaire(106).
L’objectif chirurgical est le placement d’une électrode de stimulation au contact des cordons postérieurs. Celui-ci peut se faire par abord chirurgical interlamaire (Figure 16.1) ou par voie percutanée sous contrôle fluoroscopique (Figure 16.2). La localisation optimale de l’électrode est la limite supérieure des segments médullaires correspondant au territoire douloureux. Les contacts de l’électrode ne doivent pas être trop latéraux pour que le courant ne diffuse pas aux racines dorsales adjacentes (à seuil d’excitabilité plus bas que celui des cordons dorsaux), cela entraînerait des douleurs radiculaires peu tolérables. Les contacts doivent être en regard du faisceau gracile pour les douleurs du membre inférieur et du faisceau cunéiforme pour les douleurs du membre supérieur. Pour être efficace, la stimulation doit générer des paresthésies dans le territoire douloureux. La technique percutanée comporte l’avantage d’un placement sous anesthésie locale et permet de s’assurer de la bonne couverture de la région douloureuse. Il s’agit de la méthode privilégiée pour les stimulations lombaires et thoraciques, mais elle peut être mise en œuvre en cervical dans les équipes entraînées. La technique chirurgicale par voie ouverte permet, quant à elle, le placement d’électrodes plus volumineuses. Dans certains cas la voie percutanée n’est pas possible du fait de fibrose extradurale.
- Figure 15
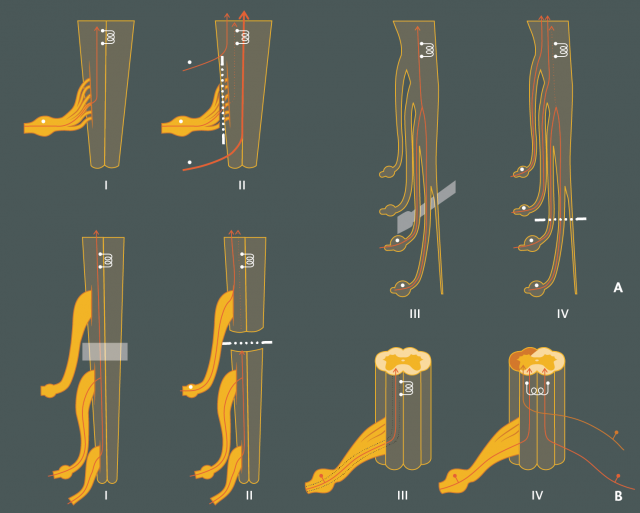
Figure 15 : Prédiction d’efficacité de la stimulation médullaire en fonction de la topographie et du caractère complet ou non des lésions nerveuses d’après l’expérience personnelle :
A/ Lésions radiculaires :
I. Lésions complètes, distales par rapport au ganglion spinal : la stimulation médullaire peut être efficace.
II. Lésions complètes, centrales par rapport au ganglion spinal (arrachement radiculaire par exemple) : la stimulation ne peut être efficace, ce qui est logique puisque dans ces conditions les fibres des colonnes dorsales ont dégénéré jusqu’aux noyaux bulbaires de Goll et Burdach (pointillés).
III. Lésions incomplètes des racines : la stimulation peut être efficace si un nombre suffisant de fibres reste fonctionnel.
IV. Lésions complètes des racines : la stimulation ne peut être efficace.
B/ Lésions médullaires :
I. Lésion médullaire incomplète : la stimulation peut être efficace
II. Lésion médullaire complète : la stimulation ne peut être efficace du fait de la dégénérescence des fibres jusqu’au tronc cérébral.
III. Lésion de siège cordonal dorsal : la stimulation peut être efficace si le déficit n’est pas important.
IV. Lésion de siège antérolatéral : la stimulation peut être efficace.
L’analgésie ne peut être obtenue que lorsque les fibres des colonnes dorsales n’ont pas subi d’importante dégénérescence. Leur fonctionnalité peut être étudiée par les potentiels évoqués somesthésiques.
- Figure 16
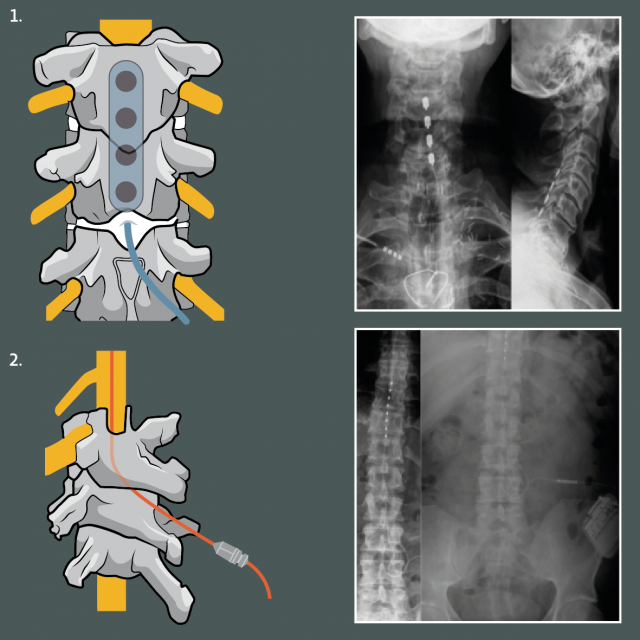
Figure 16 : 1. Stimulation médullaire épidurale par électrode “chirurgicale” implantée par abord direct interlamaire : Schéma anatomique (vue postérieure) et contrôle radiographique post-opératoire d’une implantation au niveau cervical.
2. Stimulation médullaire épidurale par électrode “percutanée” : Schéma anatomique et contrôle radiographique post-opératoire d’une électrode implantée par voie percutanée par le biais d’une aiguille de Tuohy, au niveau lombaire.
L’implantation d’un dispositif de stimulation médullaire a été encadré récemment par des recommandations de la Haute Autorité de Santé(127). Celles-ci rendent obligatoire une phase de test d’au moins une semaine durant laquelle l’électrode seule a été implantée et reliée à un stimulateur externe. A l’issue de cette phase, le soulagement du patient doit être d’au moins 50% pour bénéficier d’une implantation. La valeur prédictive de cette phase-test est contestée de même que sa durée, et il existe des recommandations différentes en fonction des pays.
A condition que les indications soient soigneusement sélectionnées, l’efficacité de la stimulation médullaire atteint 60 à 80%(52).
Les complications sont principalement : les infections (1 à 5%), les migrations de matériel (5%) et un dysfonctionnement de matériel (3%)(87). Le risque neurologique est quant à lui exceptionnel.
Le changement de générateur peut être réalisé sous anesthésie locale, et les dispositifs rechargeables doivent être réservés aux patients nécessitant une importante intensité de stimulation.
Les indications de la stimulation médullaire sont de différents types (mais dominées par les douleurs neuropathiques) :
1. Douleurs Neuropathiques :
- Les douleurs radiculaires secondaires au “Failed Back Surgery Syndrom” (FBSS). Ces douleurs sont classiquement considérées comme liées à un englobement fibreux cicatriciel des racines. En réalité elles sont souvent en relation avec une une perte de fibres résultant de la chronicité d’une compression herniaire ou arthrosique résiduelle. Les résultats sont optimaux lorsque la douleur est circonscrite et unilatérale. Enfin, les douleurs lombaires peuvent parfois être traitées par une stimulation multi-colonnes relativement haut située (Th8-Th9) mais des essais cliniques sont en cours pour en évaluer plus clairement l’efficacité(95).
- Douleurs post-amputation : En cas de douleurs neuropathiques du moignon, évoluant selon un mode de fond douloureux, de déclenchement spontané, il est possible de recourir à une stimulation médullaire. Ces douleurs sont à isoler des autres types de douleurs (douleurs fantômes, douleur de névrome, douleurs à forte composante allodynique) qui peuvent être rencontrées dans le cadre d’amputation.(Cf. Paragraphe dédié)
- Douleurs liées à des lésions de nerfs périphériques : De la même manière que pour les radiculalgies neuropathiques, une lésion nerveuse périphérique à l’origine de douleurs neuropathiques chroniques réfractaires peut bénéficier d’une stimulation médullaire. Le placement de l’électrode (Cervical, Thoracique haut ou bas) sera adapté en fonction du nerf lésé.(46)
- Neuropathies diabétiques réfractaires : Les douleurs neuropathiques peuvent atteindre jusqu’à 50% des patients atteints de diabète. Le recours à la stimulation médullaire est rare dans cette affection mais présente de bons résultats : Jusqu’à 63% de patients soulagés de 50%.(86)
2. Syndromes douloureux régionaux complexes (SDRC) :
La stimulation médullaire se révèle également efficace dans les syndromes douloureux régionaux complexe de types I et II respectivement l’algodystrophie et la causalgie :
L’électrode peut être placée au niveau cervical pour le membre supérieur ou au niveau thoracique bas pour le membre inférieur(25).
L’utilisation de la stimulation médullaire dans les syndromes douloureux régionaux complexes est supportée par de multiples études et recommandations d’experts(20,81,84,101). Celles-ci semblent mettre en évidence un bénéfice au long cours sur la douleur. Le bénéfice sur la fonction reste davantage discuté(20). La stimulation médullaire peut permettre un soulagement d’au moins 30% chez plus de 40% des patients, et ce de manière prolongée(29). Au delà des scores d’intensité douloureuse, les scores de satisfaction sont constamment élevés(20). Il semble que l’âge jeune, le stade relativement précoce de la maladie et un SDRC de type 1 soient des facteurs de bonne réponse au traitement.
3. Douleurs d’origine vasculaire :
![]() Artériopathie oblitérante des membres inférieurs :
Artériopathie oblitérante des membres inférieurs :
La stimulation médullaire peut également être efficace sur les douleurs et les phénomènes ischémiques de l’artériopathie oblitérante des membres inférieurs (AOMI). A condition que l’électrode soit située au niveau de la jonction thoraco-médullaire, la stimulation médullaire, par un effet de sympathectomie fonctionnelle, peut être bénéfique sur la douleur, mais également sur les phénomènes ischémiques et les troubles trophiques.
Le traitement conservateur et étiologique doit être envisagé en première instance. En cas d’échec, la chirurgie vasculaire doit être considérée. En cas d’échec, et en cas d’atteinte diffuse structurelle ou liée à un vasospasme, la stimulation médullaire peut être envisagée. Les meilleurs candidats sont les patients dont la microcirculation est préservée (Mesure transcutanée de la pression en Oxygène, TcPO2 entre 10 et 30mmHg).
La stimulation médullaire est bénéfique non seulement sur la douleur en soi mais aussi sur les phénomènes ischémiques : La comparaison de la stimulation médullaire au traitement conservateur seul fait apparaitre une réduction significative de la douleur, mais également une diminution de la proportion d’amputation (RR : 0,71). En outre, cela permet à une grande proportion de patient de revenir à un stade 2 de la classification de Fontaine (Douleur survenant à l’effort et non plus au repos). Ceci est supporté par une revue Cochrane initialement publiée en 2005 puis mise à jour en 2013 basée sur 6 études et un total de 450 patients(116).
![]() Angine de poitrine chronique réfractaire :
Angine de poitrine chronique réfractaire :
La stimulation peut se révéler bénéfique dans l’angine de poitrine chronique réfractaire, si l’électrode est placée au niveau de Th1.
La quantité de données apparaît moins importante que pour l’artériopathie. Néanmoins la stimulation médullaire apparaît comme un moyen thérapeutique adjuvant peu agressif et réversible. Son niveau de preuve peut être classé comme de rang 2a et son niveau de recommandation de grade A(20). Elle permet une réduction du nombre et de la durée des crises angineuses, du nombre de prises de dérivés nitrés et enfin une augmentation de la qualité de vie. Son utilisation est reconnue par les sociétés européenne et nord-américaine de cardiologie mais semble néanmoins nécessiter davantage d’investigations pour augmenter son niveau de preuve.(30)
Stimulation cérébrale profonde
De la même manière que pour les autres méthodes de neuromodulation, l’objectif de la stimulation cérébrale profonde est la modulation de l’activité de réseaux neuronaux, mais cette fois-ci au niveau des structures profondes du cerveau (Figure 17).
Les principales cibles sont atteintes par technique stéréotaxique. Il s’agit d’une part des noyaux relais somesthésiques du thalamus : VPL/VPM et d’autre part des principaux sites opiacés : Substance grise péri-aqueducale et péri-ventriculaire.
La stimulation cérébrale profonde du noyau ventro-postéro-latéral fut proposée en premier par Mazars au début des années 1970(69). Celle-ci fut suivie de la stimulation du noyau ventro-postéro-médian par Hosobuchi(40). La stimulation du complexe VPL/VPM trouve ses indications principales dans les douleurs neuropathiques haut situées, prenant une place importante lorsque la stimulation médullaire est inefficace ou contre-indiquée(55). La stimulation du faisceau pyramidal cortico-spinal dans des douleurs neuropathiques réfractaires a également été proposée sans que ses mécanismes en soient réellement compris(1,41).
La stimulation des sites opiacés, quant à elle, utilise un effet opioid-like attesté par la possibilité de son antagonisation par Naloxone(39,93). Elle semble plutôt indiquée dans les douleurs nociceptives. Il s’agit de la seule méthode de neuromodulation susceptible de jouer un rôle dans les douleurs diffuses en particulier d’origine cancéreuse et parfois dans les affections inflammatoires chroniques. Néanmoins, du fait de l’avènement des thérapies intrathécales, les indications de ce type de stimulation sont devenues rares.
Enfin, notons que la stimulation de l’hypothalamus postérieur a été remise à l’ordre du jour pour le traitement des algies vasculaires de la face chroniques réfractaires(24).
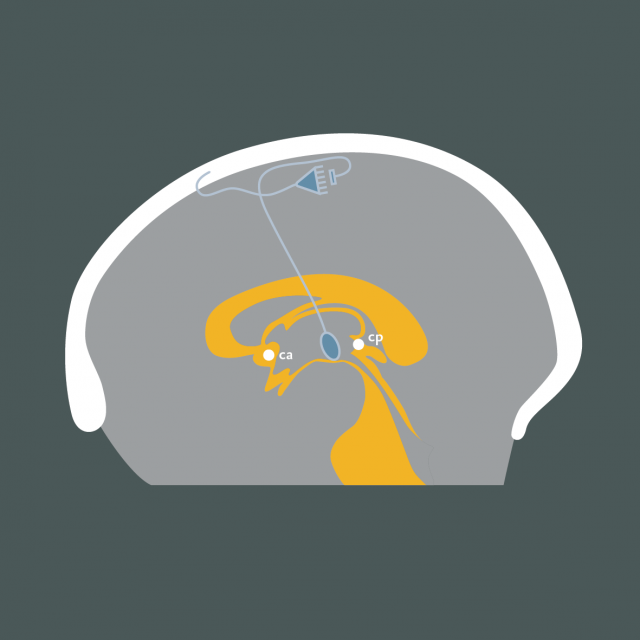
- Figure 17
Figure 17 : Représentation schématique d’une intervention de stimulation cérébrale profonde (vue sagittale) : L’électrode est placée dans le noyau VPL du thalamus par méthode stéréotaxique et repérage électrophysiologique. Celle-ci est définie par des coordonnées relatives à la ligne Ca-Cp de Talairach (commissure blanche antérieure – commissure blanche postérieure).
Stimulation du cortex moteur (gyrus précentral)
La stimulation du cortex moteur (SCM) fut introduite en 1991 par Tsubokawa(115).Les mécanismes de la stimulation du cortex moteur restent encore incomplètement expliquées. Des études d’imagerie fonctionnelle montrent une augmentation de l’activité métabolique dans lapain matrixen particulier au niveau du thalamus homolatéral à la stimulation mais aussi des régions cingulaire antérieure, orbitofrontale, insulaire et amygdalienne. Ces régions sont connues pour influer sur la composante affectivo-émotionnelle de la douleur chronique(27,85). Elle semble également renforcer l’activation des voies descendantes inhibitrices : des études ont montré la faculté de cette stimulation à inhiber les réflexes nociceptifs spinaux(26). Enfin et surtout, il a été montré récemment que cette stimulation produisait une augmentation de la libération d’opioïdes endogènes principalement au niveau du mésencéphale. Cette stimulation pourrait mettre en jeu des régions de la pain matrix rendues inactives par phénomène de diaschisis, en particulier en cas de douleurs centrales post-AVC.(63,104)
Les preuves de l’efficacité de la stimulation du cortex moteur restent encore incomplètes, mais un consensus se dégage quant à son utilisation pour les douleurs post-AVC (douleurs dites thalamiques, douleurs du syndrome de Wallenberg) et les douleurs neuropathiques trigéminales. Dans ces indications, l’efficacité est de 50% de soulagement chez 60% des patients(47,73,75,80,82,115)
La technique chirurgicale de la SCM consiste à placer une électrode en regard du cortex moteur, de préférence en situation épidurale pour des raisons d’inocuité. Le cortex moteur est repéré par neuronavigation couplée à une IRM anatomique et éventuellement fonctionnelle (Figure 18). La localisation du sillon central peut être confirmée par enregistrement des potentiels évoqués somesthésiques (zone d’inversion du potentiel N20/P20). L’électrode de stimulation est ensuite placée de manière somatotopique, au niveau de la zone correspondant à la région douloureuse(80). Elle est ensuite reliée à un générateur placé en sous-cutané. L’intensité de stimulation doit être inférieure au seuil moteur pour ne pas induire de réponses motrices parasites et ne pas déclencher de crise d’épilepsie.
Les complications post-opératoires sont rares en situation épidurale. La plus fréquente est l’infection de matériel, retrouvée dans près de 2% des cas.
Il est désormais important de mentionner la Stimulation Magnétique Transcrânienne répétitive (rTMS). Il s’agit d’un moyen de stimulation corticale non invasif dont la place au sein de l’arsenal thérapeutique reste mal précisée, mais qui peut être considéré comme un prédicteur de l’efficacité de la SCM(3,80), voire même comme un moyen thérapeutique à part entière si elle est répétée(88).
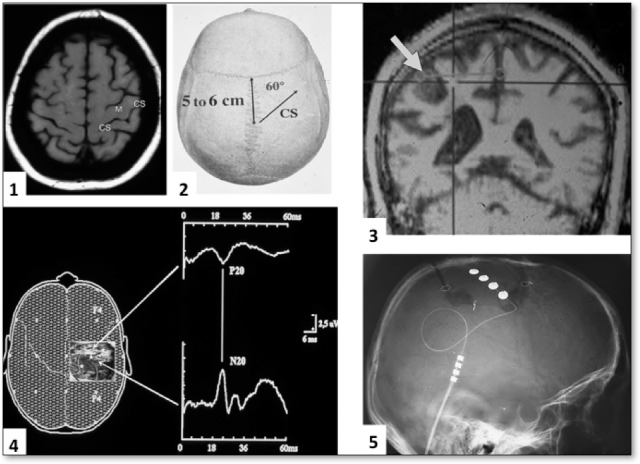
- Figure 18
Figure 18 : Stimulation du cortex moteur (précentral) :1.IRM axiale T1 identifiant le sillon central (CS) et le gyrus précentral moteur. 2.Projection du sillon central sur la voute crânienne.3.Repérage du gyrus précentral en vue coronale, par système de neuronavigation à partir de l’IRM.Ce repérage s’avère particulièrement important en cas de modification de l’anatomie par la lésion causale. 4. Repérage électrophysiologique du sillon central par l’inversion de polarité du potentiel cortical N20/P20, centrée sur la profondeur du sillon central.5. Radiographie crânienne de profil visualisant l’électrode extradurale de stimulation positionée le long du gyrus précentral (moteur).
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica

